正电子发射计算机断层X线体层成像仪(positron emission computed tomography computed tomography,PET/CT)作为一种功能和代谢成像技术,其主要是利用肿瘤细胞对用氟18脱氧葡萄糖(18F-FDG)捕获能力增高的特点,不仅可以早期发现和确定恶性肿瘤原发灶的部位、大小、代谢异常程度,清楚地了解肿瘤在全身的分布情况,还可以早期发现肿瘤的转移,对肿瘤的分期和治疗方式的选择具有不可替代的价值[1]。
肺癌包括非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),其中NSCLC主要包括鳞状细胞癌(squmous cell carcinoma,SCC)和腺癌(adenomous carcinoma,AC)。肺癌的治疗主要根据其临床分期来进行,准确分期对其治疗方式的选择和预后具有极其重要的意义。晚期肺癌主要的治疗包括最佳支持治疗、化疗、分子靶向药物治疗,以及免疫治疗等分层治疗手段;此外,随着放疗、介入,以及微创技术的发展,局部多点的治疗手段在晚期肺癌的综合治疗中亦发挥重要作用,然而对肺癌的转移规律以及局部转移的特点尚缺乏整体的认识。本研究通过分析病理证实的631例肺癌患者的PET/CT图像,旨在进一步探讨肺癌的发病部位及转移特点,为临床制定个体化的综合治疗方案,进一步提高肺癌的诊治水平提供依据。 1 资料与方法 1.1 研究对象
收集2008年6月至2013年6月,就诊于我院并行全身PET/CT检查,同时经纤维支气管镜检查、经皮肺部穿刺或手术病理证实为肺癌,并根据国际抗癌联盟第7版肺癌分期证实为Ⅳ期的患者631例。其中男性453例(71.8%),女性178例(28.2%),男女之比为2.5 ∶1,年龄26~91(58.4±10.3)岁。 1.2 检查方法
采用德国西门子Biograph 16 True Point PET/CT扫描仪行全身显像,显像剂18F-FDG由我院核医学科PET中心生产(仪器为CTIRDSⅢ型回旋加速器及自动化合成模块)。患者在检查前禁食6 h以上,测身高、体质量,经血糖测定仪确认空腹血糖在正常水平,糖尿病患者则需经临床控制血糖到正常范围后再行检查。检查当日患者禁止做剧烈运动,静脉注射18F-FDG(pH=7.3,放化纯度>97%,注射剂量按体质量为5.55 MBq/kg),注射后静息平卧60 min,排尿后行常规扫描。CT扫描参数为X射线管电压为120 kV,管电流为 200~230 mA,螺距比1 ∶0.938,扫描层厚2.5~ 5.0 mm。PET采集条件为2.5 min/床位,6~7个床位,3D扫描,迭代法重建。图像重建后由2位核医学科诊断医师采用双盲法分析PET/CT图像,确认放射性核素浓聚灶,并记录病变标准摄取量(standardised uptake value,SUV)。PET/CT图像清晰、对比度好、融合图像对位良好时,为合格图像。以SUVmax4.5为诊断界值判断纵隔淋巴结有无转移,即SUVmax≤4.5判为良性(无转移),SUVmax>4.5判为恶性(有转移)。意见一致时可确立诊断,意见不一致时,经过科室讨论后再行确定。
将原发肺部病灶按照发病部位划分为左肺上叶、下叶,右肺上叶、中叶、下叶5个部位,按照发病类型分为中央型和周围型。转移病灶分别淋巴结转移和远处脏器转移。其中淋巴结转移分为局部淋巴结转移(纵隔和肺门淋巴结)和远处淋巴结转移(锁骨区、颈部、腋窝、腹股沟、腹腔、腹膜后以及其他部位淋巴结)。远处脏器转移包括肺内转移、胸膜转移、肾上腺转移、骨转移、肝转移、脑转移、皮肤或皮下软组织转移、胰腺转移、肾脏转移、脾脏转移、心包转移、甲状腺转移和肌肉转移。按照原发肿瘤的病理类型,分为NSCLC、AC、SCC 3组,分别对3种肺部常见肿瘤的转移特点进行统计和分析。 1.3 统计学方法
采用统计软件SPSS 17.0进行χ2检验。 2 结果 2.1 病理类型特点
631例患者中,经病理学检查证实SCLC 67例(10.6%),NSCLC 564例(89.4%),其中AC 339例 (53.7%),SCC 225例(35.7%)。其中男性:AC 248例(54.7%),SCC 160例(35.3%),NSCLC 45例(9.9%); 女性:AC 91例(51.1%),SCC 65例(36.5%),NSCLC 22例(12.4%)。 2.2 病理类型与发生部位的关系
67例SCLC中左肺上叶21例(31.34%),左肺下叶12例(17.91%),右肺上叶10例(14.93%),右肺中叶5例(7.46%),右肺下叶11例(16.42%),中央型35例(52.24%),周围型16例(23.88%),未分型 16例(23.88%);339例AC中左肺上叶86例(25.37%),左肺下叶47例 (13.86%),右肺上叶101例(29.79%),右肺中叶28例(8.26%),右肺下叶47例(13.86%),中央型41例(12.09%),周围型205例(60.47%),未分型93例(27.43%);225例SCC中左肺上叶52例(23.11%),左肺下叶44例(19.56%),右肺上叶 42例(18.67%),右肺中叶18例(8.00%),右肺下叶48例(21.33%),中央型113例(50.22%),周围型67例(29.78%),未分型45例(20.00%)。 2.3 肺癌病理类型与淋巴结转移的关系
631例晚期肺癌,358例肺门淋巴结转移(56.74%),461例纵隔淋巴结转移(73.06%),而远处淋巴结转移多见于锁骨上和颈部(19.18%和10.62%)。SCLC和SCC局部淋巴结转移部位,以肺门淋巴结为最多(76.12%、81.78%),且明显高于AC(36.28%,P<0.05)。AC局部淋巴结转移的部位以纵隔淋巴结为最多(73.45%),且在远处淋巴结转移中较其他病理类型更易发生锁骨区淋巴结转移(P<0.05)。SCC在腹腔淋巴结转移中发生率(2.67%)明显低于SCLC和AC(P<0.05,表 1)。
| 类型 | n | 局部淋巴结转移 | 远处淋巴结转移 | |||||
| 纵隔 | 肺门 | 锁骨区 | 颈部 | 腹股沟 | 腹腔 | 其他 | ||
| SCLC | 67 | 48(71.64) | 51(76.12)a | 11(16.42)a | 6(8.96) | 0(0.00) | 7(10.45)a | 2(2.99) |
| AC | 339 | 249(73.45) | 123(36.28) | 80(23.60) | 40(11.80) | 4(1.18) | 33(9.73) | 18(5.31) |
| SCC | 225 | 164(72.89) | 184(81.78)a | 30(13.33)a | 21(9.33) | 2(0.89) | 6(2.67)a | 9(4.00) |
| 总体 | 631 | 461(73.06) | 358(56.74) | 121(19.18) | 67(10.62) | 6(0.95) | 46(7.29) | 29(4.60) |
| a:P<0.01,与AC比较 | ||||||||
631例晚期肺癌,远处器官转移多见于胸膜、骨骼和肺内,转移率分别为35.34%、27.73%和26.78%。SCLC、SCC易发生远处转移的部位依次是:胸膜、肺内、骨、肝、肾上腺、脑,AC易发生远处转移的部位依次是:胸膜、骨、肺内、肾上腺、肝、脑。组间比较AC胸膜(39.53%)、脑(9.44%)、骨(38.35%)转移明显高于SCLC和SCC(P<0.05)。SCLC肝转移(17.91%)明显高于AC(9.73%)和SCC(7.11%),且差异有统计学意义(P<0.05)。SCC(5.53%)肾上腺转移明显低于其他病理类型(P<0.05,表 2)。
| 类型 | n | 肺内 | 胸膜 | 肝脏 | 脑 | 肾上腺 | 骨 | 皮下 | 胰腺 | 肾脏 | 脾脏 | 心包 | 甲状腺 | 肌肉 |
| 总体 | 631 | 169(26.78) | 223(35.34) | 31(4.91) | 43(6.81) | 58(9.19) | 182(28.84) | 23(3.65) | 5(0.79) | 4(0.63) | 3(0.48) | 26(4.12) | 12(1.90) | 9(1.43) |
| SCLC | 67 | 16(23.88) | 20(29.85)a | 12(17.91)a | 5(7.46)b | 8(11.94)a | 16(23.88)b | 3(4.48) | 2(2.99) | 0(0.00) | 1(1.49) | 3(4.48) | 0(0.00) | 0(0.00) |
| AC | 339 | 99(29.20) | 135(39.82) | 33(9.73) | 32(9.44) | 38(11.21) | 130(38.35) | 15(4.42) | 4(1.18) | 2(0.59) | 0(0.00) | 12(3.54) | 9(2.65) | 8(2.36) |
| SCC | 225 | 54(24.00) | 68(30.22)a | 16(7.11)c | 5(2.22)b | 12(5.53)c | 36(16.00)b | 5(2.22) | 1(0.44) | 2(0.89) | 2(0.89) | 11(4.89) | 3(1.33) | 1(0.44) |
| a:P<0.05,b:P<0.01,与AC比较;c:P<0.05,与SCLC比较 | ||||||||||||||
骨是肺癌远处转移的好发部位之一。在631例 Ⅳ期肺癌患者中,经PET/CT诊断发现182例发生骨转移,SCC 36例,AC 130例,NSCLC 16例,其中132例可以明确骨转移部位,1例胸腰椎伴多发骨转移未明确部位及数量,49例诊断未提供明确骨转移部位,可以明确的部位数量累计为275个(表 3)。基于上述资 料分析,本研究肺癌骨转移发生率为28.84%(182/631),其中NSCLC骨转移率(29.43%)(166/564)高于SCLC(23.88%,16/67)。从不同病理类型角度看,AC骨转移率最高38.35%(130/339),其次是SCLC(23.88%)(16/67)、SCC(16%)(36/225)(图 1);在骨转移的患者中,肺AC的占比高达71.43%。脊柱是最常转移部位(44.36%),依次是髋骨(22.55%),肋骨(19.64%)。脊柱不同节段转移比例存在差异,其中胸椎(17.82%)为最易发生部位,依次为腰椎(12%)、骶椎(7.64%)、颈椎(6.91%)。
| 类型 | n | 颈椎 | 胸椎 | 腰椎 | 骶椎 | 颅骨 | 锁骨 | 肩胛骨 | 胸骨 | 肋骨 | 髋骨 | 四肢骨 |
| 总体 | 275 | 19(6.91) | 49(17.82) | 33(12.00) | 21(7.64) | 5(1.82) | 4(1.45) | 7(2.55) | 7(2.55) | 54(19.64) | 62(22.55) | 14(5.09) |
| AC | 196 | 16(8.16) | 34(17.35) | 21(10.71) | 14(7.14) | 4(2.04) | 2(1.02) | 6(3.06) | 3(1.53) | 38 (19.39) | 47(23.98) | 11(5.61) |
| SCC | 61 | 3(4.92) | 12(19.67) | 9(14.75) | 5(8.20) | 1(1.64) | 1(1.61) | 0(0.00) | 4(6.56) | 14(22.95) | 9(14.75) | 3(4.92) |
| SCLC | 18 | 0(0.00) | 3(16.67) | 3(16.67) | 2(11.11) | 0(0.00) | 1(5.56) | 1(5.56) | 0(0.00) | 2(11.11) | 6(33.33) | 0(0.00) |
| χ2 | 2.191 | 0.189 | 1.116 | 0.403 | 0.399 | 2.384 | 2.461 | 5.242 | 1.261 | 3.551 | 1.080 | |
| P | 0.334 | 0.91 | 0.572 | 0.818 | 0.819 | 0.304 | 0.292 | 0.073 | 0.532 | 0.169 | 0.583 |
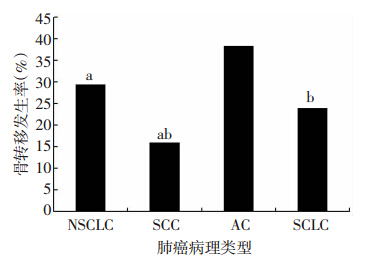 |
| a: P<0.05,与SCLC比较;b: P<0.05,与AC比较 图 1 肺癌骨转移发生率情况 |
根据不同分类,进一步分析骨转移频次最高的前4个部位。NSCLC依次是髋骨(21.79%)>肋骨(20.23%)>胸椎(17.9%)>腰椎(11.67%);而SCLC是髋骨(33.33%)>胸椎(16.67%)、腰椎(16.67%)>肋骨、骶椎(11.11%),本研究未观察到SCLC颅骨、颈椎、胸骨、四肢骨转移;AC是髋骨(23.98%) >肋骨(19.39%)>胸椎(17.35%)>腰椎(10.71%); SCC是肋骨(22.95%)>胸椎(19.67%)>腰椎(14.75%)、髋骨(14.75%),本研究未观察到SCC肩胛骨转移;此外,SCC胸骨转移比例明显高于AC(P=0.035)。 3 讨论
近年来,全球肺癌的发病率和死亡率显著上升,是目前危害人类健康的主要肿瘤之一。肺癌的侵袭性极强,可经血行、淋巴道、脱落细胞等方式转移到肺门、纵隔等淋巴结组织及全身各组织器官,因而早期发现、早期诊断、正确分期及合理的治疗对肺癌患者尤为重要。影像学检查常用于肺癌诊断、治疗方案的选择、疗效观察及预后评估[2]。PET/CT结合了PET的功能显像与CT的解剖形态影像,以同时反映病灶的病理生理变化及形态结构变化,并借助SUV值的量化分析及高分辨率CT的形态特点,可以明显提高诊断的准确性,较传统检查在肿瘤分期及预后判断方面均具有更高的优越性[3]。
肺癌淋巴结转移部位是判断预后和制定治疗策略的重要参考因素[4, 5],目前PET/CT已广泛应用于肺癌的分期诊断,其既可发现异常淋巴结,又可对其精确定位,提高了对N1和N2的分辨力,利于肺癌的治疗前评估和放疗计划的制订。Li等[6]对200例Ⅰ期肺癌患者回顾性分析,全部行PET/CT检查后,均行肺癌根治术,并经病理确诊,PET/CT诊断淋巴结转移的敏感性、特异性、阳性预测值和阴性预测值分别为44%、83%、78%和91%,提示PET/CT检查可提高对肺癌患者纵隔淋巴结分期的准确性。本研究中,631例Ⅳ期肺癌患者,SCLC 67例,SCC 225例,AC 339例,依据PET/CT检查结果均不同程度的发生了淋巴结转移,其可能原因是脏层胸膜受侵犯,因脏层胸膜具有丰富的淋巴管,并形成内部交通网络包绕于肺表面,通过促进新生淋巴管和淋巴管的重塑,深入肺实质并汇聚于支气管淋巴管,延伸向肺门淋巴结区域,该网络形成了淋巴结转移的重要通道,在非小细胞肺癌中尤其明显[5, 7]。本研究发现不同病理类型肺癌患者淋巴结转移部位存在差异,SCLC和SCC更易发生肺门淋巴结转移,AC淋巴结转移以纵隔为多,且更易发生锁骨上淋巴结转移。提示在行肺癌的治疗和全程管理中需要针对不同病理类型肺癌区别对待,如AC的术前分期以及放疗定位时,应特别注意检查锁骨上淋巴结转移情况。Dizendorf等[8]对202名拟行治疗的肺癌患者行PET/CT检查后发现,9%的患者因发现了新的淋巴结转移而改变了治疗策略,放疗患者12%改变了放疗 剂量,6%改变了放疗范围。但PET/CT评估淋巴结转移虽特异性高,但敏感性较低,可能原因是其在某些肉芽肿性炎、非特异性炎症等情况下也可表现为高摄取[9]。
肺癌患者治疗策略的选择以及预后判断与是否存在远处转移亦密切相关,PET/CT可全面观察机体各部位的代谢情况,对远处转移病灶具有较高的检出率[10],特别是早期结构学无改变而功能学有改变的隐匿转移病灶。王烽等[11, 12]研究显示,PET-CT对于肺外转移诊断的特异度、敏感度和准确性分别可达92%、98%和97%,Ibeas等[13]研究发现PET/CT较传统检查额外发现了11%的远处转移,大量的研究均提示,PET/CT较CT相比,明显提高了对肺癌远处转移诊断的准确性,由此改变了患者的治疗策略[14, 15]。本研究发现,PET/CT检查631例Ⅳ期肺癌患者的远处转移病灶包括肺内、胸膜、肝脏、脑、肾上腺、骨、皮肤、胰腺、肾脏等,其中Ⅳ期肺癌中AC易发生远处转移的部位依次:胸膜>骨>肺内>肾上腺>肝>脑。可能是AC多为周围型且倾向于管外生长,富有血管,故主要以血道转移为主,可较早出现局部浸润和血行转移,这与其转移速率较快是一致的,提示AC虽然患病率较低,但胸膜、骨骼、肝脏和脑等重要脏器的转移发生率较高,其预后较差。有研究证实早期发现无临床症状的NSCLC或者NSCLC术后复发予适当干预后较已出现临床症状的患者生存期明显延长[16, 17]。而PET/CT在诊断远处转移时明显优于传统检查,能够更早的发现远处转移病灶,因此对于远处转移发生较快且预后较差的AC,及早行PFT/CT检查明确远处转移,可能更有利于合理治疗策略的选择。
骨是肺癌好发的转移部位,30%~40%患者在病情进展中发生了骨转移[18]。尸检发现36%肺癌患者有骨转移[19],22%~60%患者的骨髓有微转移灶[20]。发生骨转移的肺癌患者生存质量明显下降,骨相关事件的发生导致预后较差,生存时间明显缩短[21]。本研究通过PET/CT分析发现,27.73%的Ⅳ期肺癌患者发生了骨转移。总体上SCLC骨转移率高于NSCLC,进一步分析发现AC骨转移发生率显著高于SCC和SCLC,而SCC骨转移率明显低于SCLC。AC好发骨转移的特点除可能与其易转移的特性有关外,还可能与AC细胞与骨的相互作用有关[22]。就骨转移的部位而言,本研究分析发现44.36%的骨转移发生在脊柱,其中胸椎最为常见,此外19.64%肋骨被侵犯。坐骨、耻骨、髂骨共同组成了骨盆骨性结构,合称髋骨,其结构和功能相似,常发生两者或三者同时转移,本研究将三者合并分析,髋骨占比22.55%。不同的病理类型骨转移部位分布有一定差异,AC髋骨转移率明显高于肋骨,而SCC则相反。早期诊断骨转移难度较大,患者往往是因为骨痛或发生骨相关事件后才被诊断。而PET/CT能够很好地发现骨转移病灶,及早行骨治疗。肺癌骨转移常造成溶骨性破坏,治疗目标是减少瘤荷、减轻骨痛、预防骨相关事件、提高生活质量[23]。Ⅳ期肺癌患者骨转移的治疗主要以放化疗为主[24, 25]。放化疗联合早期双磷酸盐治疗能够更为有效减轻骨痛及预防骨相关事件发生[26, 27]。而PET/CT为上诉治疗提供了可能。
本研究结果表明,①SCLC和SCC局部淋巴结转移以肺门淋巴结转移率最高,且明显高于AC。②AC局部淋巴结转移的部位以纵隔淋巴结转移率最高,且较其他病理类型更易发生锁骨上淋巴结转移。③Ⅳ期肺癌远处转移率与年龄无关,男性仅略高于女性。④Ⅳ期肺癌远处转移发生率与病理组织学类型有明显关系,其中AC转移率最高,AC易发生远处转移的部位依次是:胸膜、骨、肺内、肾上腺、肝、脑,而SCLC、SCC易发生远处转移的部位依次是:胸膜、肺内、骨、肝、肾上腺、脑。⑤不同病理组织学类型的肺癌,其不同部位转移发生率有明显差异。AC以肺内、胸膜、脑、骨转移为主,SCLC以肝转移为主,而SCC肾上腺转移明显降低。⑥AC骨转移发生率最高,胸腰椎、肋骨及髋骨是肺癌骨转移的好发部位。
PET/CT对于诊断Ⅳ期肺癌患者淋巴结和远处转移有较高价值,对肺癌的分期和临床整体治疗方案的制定和优化,以及肺癌治疗的全程管理具有非常重要的作用。然而,当肿瘤直径小于0.7 cm,肿瘤分化良好导致SUV低等均可导致假阴性结果,PET/CT的融合图像能显示病灶的阳性征象,并能对病灶进行半定量诊断,但对细节征象显示不清[28],因此在临床工作中需对具体病例结合影像学检查和病理结果综合分析,进而不断提高对肺癌的全程管理和综合治疗水平。
| [1] | 许泽清, 段小蓓, 贾晓娟, 等. 18F-FDG PET/CT诊断非小细胞肺癌纵隔淋巴结转移[J]. 中国医学影像技术, 2013, 29(12): 1989-1993. |
| [2] | 蔡莉, 张驰, 张志强, 等. PET/CT在肺癌诊断中价值初探[J]. 中国医学装备, 2013, 10(1): 90-91. |
| [3] | 朱峰, 王跃涛, 钱作宾, 等. 18F-FDG PET/CT 显像对胃肠道恶性肿瘤分期、术后再分期诊断的临床价值[J]. 中国医疗设备, 2010, 25(1): 127-130. |
| [4] | Pfannschmidt J, Muley T, Bulzebruck H, et al. Prognostic assessment after surgical resection for non-small cell lung cancer: experiences in 2083 patients[J]. Lung Cancer, 2007, 55(3): 371-377. |
| [5] | Christiansen A, Detmar M. Lymphangiogenesis and cancer[J]. Genes Cancer, 2011, 2(12): 1146-1158. |
| [6] | Li X, Zhang H, Xing L, et al. Mediastinal lymph nodes staging by 18F-FDG PET/CT for early stage non-small cell lung cancer: a multicencter study[J]. Radiother Oncol, 2012, 102(2): 246-250. |
| [7] | Kudo Y, Saji H, Shimada Y, et al. Impact of visceral pleural invasion on the survival of patients with non-small cell lung cancer[J]. Lung Cancer, 2012, 78(2): 153-160. |
| [8] | Dizendorf E V, Baumert B G, von-Schulthess G K, et al. Impact of whole-body 18F-FDG PET on staging and managing patients for radiation therapy[J]. J Nucl Med, 2003, 44(1): 24-29. |
| [9] | Darling G E, Maziak D E. Inculet R I, et al. Positron emission tomography-computed tomography compared with invasive mediastinal staging in non-small cell lung cancer: results of mediastinal staging in the early lung positron emission tomography trial[J]. J Thorac Oncol, 2011, 6(8): 1367-1372. |
| [10] | Birin O, Kappetein A P, Stijnen T, et al. Meta-analysis of positron emission tomography and computed tomographyic inaging in detecting mediastinal lymph node metastases in nonsmall cell lung cancer[J]. Ann Thorac Surg, 2005, 79(1): 375-382. |
| [11] | 王烽, 田锋, 佟玉筠. PET-CT在周围型非小细胞肺癌N分期及淋巴结清扫中的价值[J]. 中华临床医师杂志: 电子版, 2013, 7(2): 609-612. |
| [12] | 张曙光, 宋平平, 张百江. PET/CT在肺癌治疗应用价值研究的现状[J]. 中华肿瘤防治杂志, 2013, 20(5): 392-395, 400. |
| [13] | Ibeas P, Cantos B, Gasent J M, et al. PET-CT in the staging and treatment of non-small-cell lung cancer[J]. Clin Transl Oncol, 2011, 13(6): 368-377. |
| [14] | Mah K, Caldwell C B, Ung Y C, et al. The impact of (18)FDG-PET on target and critical organs in CT-based treatment planning of patients with poorly defined non-small-cell lung carcinoma: a prospective study[J]. Int J Radiat Oncol Biol Phys, 2002, 52(2): 339-350. |
| [15] | 于丽娟, 锻玉, 梁秀艳, 等. 18F-FDG PET/CT显像在肺癌诊断及探查转移灶中的价值[J].中国医学影像技术, 2007, 23(4): 605-607. |
| [16] | Westeel V, Choma D, Clement F, et al. Relevance of an intensive postoperative follow-up after surgery for non-small cell lung cancer[J]. Ann Thorac Surg, 2000, 70(4): 1185-1190. |
| [17] | Sugimura H, Nichols F C, Yang P, et al. Survival after recurrent nonsmall-cell lung cancer after complete pulmonary resection[J]. Ann Thorac Surg, 2007, 83(2): 409-418. |
| [18] | Al-Husaini H, Wheatley-Price P, Clemons M, et al. Prevention and management of bone metastases in lung cancer: a review[J]. J Thorac Oncol, 2009, 4(2): 251-259. |
| [19] | Coleman R E. Clinical features of metastatic bone disease and risk of skeletal morbidity[J]. Clin Cancer Res, 2006, 12(20 Pt 2): 6243s-6249s. |
| [20] | Coello M C, Luketich J D, Litle V R, et al. Prognostic significance of micrometastasis in non-small-cell lung cancer[J]. Clin Lung Cancer, 2004, 5(4): 214-225. |
| [21] | Berenson J R, Rajdev L, Broder M. Managing bone complications of solid tumors[J]. Cancer Biol Ther, 2006, 5(9): 1086-1089. |
| [22] | Roato I. Bone metastases: When and how lung cancer interacts with bone[J]. World J Clin Oncol, 2014, 5(2): 149-155. |
| [23] | Suva L J, Washam C, Nicholas R W, et al. Bone metastasis: mechanisms and therapeutic opportunities[J]. Nat Rev Endocrinol, 2011, 7(4): 208-218. |
| [24] | Zeng L, Chow E, Zhang L, et al. Comparison of pain response and functional interference outcomes between spinal and non-spinal bone metastases treated with palliative radiotherapy[J]. Support Care Cancer, 2012, 20(3): 633-639. |
| [25] | Yoh K, Kubota K, Ohmatsu H, et al.Feasibility study of zoledronic acid plus cisplatin-docetaxel as first-line treatment for advanced non-small cell lung cancer with bone metastases[J]. Anticancer Res, 2012, 32(9): 4131-4135. |
| [26] | Henry D, Vadhan-Raj S, Hirsh V, et al. Delaying skeletal-related events in a randomized phase 3 study of denosumab versus zoledronic acid in patients with advanced cancer: an analysis of data from patients with solid tumors[J]. Support Care Cancer, 2014, 22(3): 679-687. |
| [27] | Prommer E. Palliative Oncology: Denosumab[J]. Am J Hosp Palliat Care, 2014, [Epub ahead of print]. |
| [28] | 张清, 刘阳, 张锦明, 等. 11C-胆碱PET在肺癌诊断与分期中的应用[J]. 第三军医大学学报, 2008, 30(23): 2233-2235. |



