外伤性癫痫(posttraumatic epilepsy,PTE)是颅脑损伤后的常见并发症,常给患者带来极大影响,对于其发生机制和治疗的研究一直是神经科学关注的重点。近年研究表明,哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin,mTOR complex 1,mTORC1)介导的信号通路异常激活与外伤性癫痫有着重要联系,在脑外伤及PTE动物模型中mTORC1磷酸化激活,活化的mTORC1通过磷酸化下游多种效应分子可产生多重病理生理改变进而参与癫痫的发生、发展,而抑制mTORC1具有抗癫痫发生的作用[1, 2, 3]。姜黄素是一种具有多重神经保护作用的多酚类化合物,对PTE也表现出一定的治疗作用[4],但国内外此类研究较少,其发挥抗癫痫作用的机制仍不完全清楚,姜黄素是否通过调节mTORC1而发挥抗癫痫作用尚少见相关报道。本研究试图探究姜黄素在FeCl3皮层注射所致外伤性癫痫鼠模型中的抗癫痫效应以及对mTORC1磷酸化的影响。 1 材料与方法 1.1 材料
试剂:100 mmol/L FeCl3溶液(Sigma公司),兔抗鼠mTORC1、p-mTORC12448单克隆抗体(CST公司),兔抗鼠GAPDH单克隆抗体(北京博奥森生物技术有限公司),姜黄素(美国Sigma公司)。 1.2 动物及分组
雄性健康成年SD大鼠120只,体质量200~250 g,由重庆医科大学实验动物中心供给。按抽签法随机分为对照组、模型组和干预组,每组40只。模型组及干预组构建大鼠皮层注射FeCl3所致外伤性癫痫模型。干预组于造模前1 h腹腔注射姜黄素[200 mg/(kg·d),二甲基亚砜(DMSO)稀释溶解][5],连续14 d,对照组及模型组注射相同体积DMSO。各组于造模后6、24 h、3、7、14 d时间点分别选取8只大鼠进行实验。 1.3 外伤性癫痫模型构建
大鼠用3.5%水合氯醛溶液(1 mL/100 g)腹腔麻醉后于立体定位仪上固定,手术处理后用微量注射针将FeCl3(100 mmol/L,pH 1.5)溶液5 μL于5 min内匀速注射至大鼠左侧感觉运动皮层(矢状缝旁2 mm冠状缝后1 mm),进针深度3 mm,注射完后留针头5 min 以防外溢,对照组用同样方法注射等量生理盐水[6]。各实验组大鼠于注射孔外另钻5孔,参考D’Ambrosio等[7]的方法以前囟为原点,矢状缝为y轴,过原点作垂直于y轴直线x轴,单位mm,以坐标1(-4,0),2(4,0),3(-4,-6),4(4,-6)钻4个孔,额骨正中钻孔5做参考电极。将前端钝圆的螺丝置于孔内,紧贴硬脑膜,牙托粉固定电极。 1.4 外伤性癫痫模型行为学观察及成功的判定
造模后持续观察大鼠6 h行为学改变,用改良Racine评分法[6](无任何癫痫发作记0分;凝视发作记1分;规律点头或湿狗样抖动,伴或不伴面部抽动记2分;单侧前肢抖动记3分;站立、双前肢抖动及持续性点头记4分;双侧肢体颤动,失去平衡跌倒而全身性 强直阵挛性发作记5分;发作衰竭死亡记6分),将≥3分视为造模成功,对造模失败及死亡的大鼠剔出实验并补齐。以后每日连续观察6 h,记录癫痫发作情况。 1.5 皮层脑电图记录
于各时间点处死大鼠前监测大鼠皮层脑电1 h,以尖波、棘波波幅到背景波2倍及以上并且超过5 s认为脑电图癫痫波发作,记录各组大鼠脑电波幅及癫痫波次数。脑电图采集参数:高频滤波35 Hz,灵敏度0.8 μV,扫描速度30 mm/s,波幅5 mm/50 μV,时间常数0.3 s[8]。 1.6 标本采集及Western blot、免疫组化及透射电镜检测
各组大鼠于各时间点用3.5% 水合氯醛溶液(1 mL/100 g)腹腔注射麻醉后,选取其中4只迅速断头取脑,取注射部位皮层脑组织以4 ℃ PBS缓冲液100 mL冲洗3次后置入-80 ℃冰箱内保存,用于Western blot检测。剩余大鼠用生理盐水及4%多聚甲醛经左心室灌注后,取注射孔周围皮层脑组织并分为两部分,分别于4%多聚甲醛及4%戊二醛溶液中浸泡后用于免疫组织化学及透射电镜检测。
Western blot 检测:提取蛋白质后用BCA法检测蛋白质浓度并标化,用GAPDH为内 参蛋白。蛋白样品加入变性缓冲液后于沸水中保持5 min,10 000 r/min 离心5 min后上样,SDS-PAGE电泳后转至硝酸纤维膜,于5%脱脂牛奶中4 ℃封闭过夜;分别加入抗p-mTORC1 抗体(1 ∶1 000)、抗mTORC1抗体(1 ∶1 000)、抗GAPDH抗体(1 ∶2 000)4 ℃孵育过夜,加入二 抗(1 ∶4 000)于37 ℃孵育1 h,DAB法显色,Quantity One图像分析软件对蛋白条带进行灰度值定量分析并统计。
免疫组化检测:取出已包埋的石蜡块行冠状面切片,片厚5 μm,S-P染色。PBS代替一抗作阴性对照。抗p-mTORC1一抗浓度为1 ∶100。400倍光镜视野下观察组化染色结果,采用Image-Pro Plus6.0图像分析系统半定量分析免疫阳性产物平均光密度值。
透射电镜观察:切取注射孔周围皮层脑组织,标本大小为1 mm3,于4%戊二醛中固定后按要求进行电镜标本制备,透射电镜下观察神经元超微结构。 1.7 统计学分析
计量资料数据以x±s表示,采用SPSS 18.0统计软件进行数据处理,多组间均数比较用单因素方差分析,用LSD-t检验比较两两之间的差异。 2 结果 2.1 行为学观察
对照组大鼠无癫痫发作。模型组及干预组均可见癫痫发作,造模成功率分别为模型组85.1%(40/47),干预组81.6%(40/49)。大鼠于造模后约1.5 h麻醉清醒,出现不停头颈右偏,右侧绕尾打转,过程中可见不同程度的发作,如规律点头、凝视、面部抽动、单侧的前肢抖动、双前肢抖动和持续性点头、站立、双侧肢体颤动、跌倒、全身强直阵挛性发作。发作后可见瘫软,发作间期大鼠易激惹、进食减少,实验中无大鼠衰竭死亡。癫痫发作频率及等级均在造模后6 h内最高,平均6~30 min就发作1次,持续1~3 min,3 d内癫痫发作频率仍较高,7 d后发作次数有所减少,但仍可见癫痫发作。干预组大鼠癫痫发作次数较模型组显著减少(P<0.05),发作程度明显减低(P<0.05,表 1)。
| 组别 | 6 h | 24 h | 3 d | 7 d | 14 d | |||||
| 次数 | 评分 | 次数 | 评分 | 次数 | 评分 | 次数 | 评分 | 次数 | 评分 | |
| 对照组 | 0 | 1.03±0.47 | 0 | 1.02±0.47 | 0 | 1.17±0.25 | 0 | 1.22±0.25 | 0 | 1.18±0.21 |
| 模型组 | 8.8±1.7a | 4.11±0.20a | 14.9±2.0a | 4.10±0.22a | 19.9±2.8a | 4.00±0.22a | 24.5±3.4a | 3.93±0.14a | 31.5±4.2a | 3.81±0.11a |
| 干预组 | 5.2±1.4b | 3.82±0.13b | 7.4±1.5b | 3.73±0.10b | 8.5±1.2b | 3.67±0.11b | 9.4±1.3b | 3.62±0.13b | 10.3±1.8b | 3.61±0.15b |
| a:P<0.05,与对照组比较;b:P<0.05,与模型组比较 | ||||||||||
对照组大鼠的脑电以β、α为主,散在θ波,波幅均值小于200 μV,未见癫痫波。各时间点模型组及干预组均可见癫痫波,表现为单棘波、双棘波、棘慢波、尖波等多种形式,波幅可高达300 μV,发作后可有抑制波。波形异常程度与大鼠癫痫的发作次数及严重程度基本一致。模型组主要在1、3导联观察到癫痫波,偶可见全脑爆发样癫痫波,脑电波平均波幅显著高于对照组(P<0.05)。干预组在1、3导联可见癫痫波,未见全脑爆发样癫痫波,脑电波平均波幅及癫痫波发作次数较模型组均显著减低(P<0.05,图 1,表 2)。
| 组别 | 6 h | 24 h | 3 d | 7 d | 14 d | |||||
| 次数 | 波幅(μV) | 次数 | 波幅(μV) | 次数 | 波幅(μV) | 次数 | 波幅(μV) | 次数 | 波幅(μV) | |
| 对照组 | 0 | 71.97±11.23 | 0 | 67.97±14.65 | 0 | 72.70±12.80 | 0 | 71.88±12.59 | 0 | 69.24±7.76 |
| 模型组 | 11.1±2.2a | 211.43±19.93a | 7.3±1.8a | 223.92±24.42a | 7.5±2.2a | 226.38±20.06a | 5.8±2.1a | 207.26±16.63a | 5.4±2.0a | 208.75±17.93a |
| 干预组 | 5.1±1.8b | 147.29±20.75b | 3.1±1.5b | 141.32±21.36b | 2.6±1.4b | 139.97±16.91b | 1.8±1.2b | 127.26±23.02b | 1.1±1.0b | 114.99±13.32b |
| a: P<0.05,与对照组比较;b: P<0.05,与模型组比较 | ||||||||||
 |
| A:对照组;B:模型组;C:干预组 图 1 造模后24 h各组大鼠皮层脑电图表现 |
对照组中大鼠注射侧皮层神经元亚细胞超微结构正常。模型组大鼠在造模早期,部分神经细胞胞质水肿变性,细胞器破坏减少,异染色质增多。注射第7天,细胞结构紊乱,染色质边聚,可见早期凋亡。注射第14天,可见较多细胞膜结构的溶解和破坏,髓鞘化改变,大量的肿胀的线粒体、空泡及溶酶体,多量畸形的细胞核,异染色质凝聚,细胞死亡。干预组大鼠的情况介于上两组之间,未见明显大量细胞变性、死亡等改变,神经元亚细胞结构基本正常,少量异染色质聚于细胞核,尚可见均匀的胞质和丰富的线粒体和内质网(图 2)。
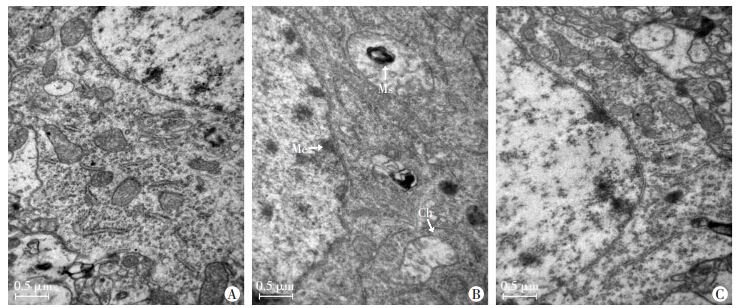 |
| A:对照组;B:模型组;C:干预组 Ms:髓鞘;Me:异染色质边聚;Ch:肿胀的线粒体 图 2 造模14 d电镜下观察各组大鼠神经元超微结构(TEM) |
mTORC1在各时间点表达无明显组间差异(P>0.05),提示mTORC1在中枢处于稳定表达状态,不受 造模及用药干预的影响。p-mTORC1则在对照组中低表达,在模型组中表达持续增高。以p-mTORC1/ mTORC1的比值代表mTORC1的活化程度。p-mTORC1/ mTORC1在模型组中各时间点均显著高于对照组(P<0.05),并于术后24 h达到峰值,3 d内保持较高水平,在干预组中各时间点均显著低于模型组(P<0.05,图 3)。
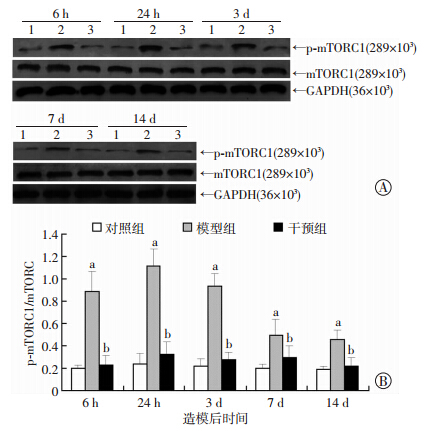 |
| A:Western blot检测结果 1:对照组;2:模型组;3:干预组;B:半定量分析结果 a:P<0.05,与对照组比较;b:P<0.05,与模型组比较 图 3 Western blot检测p-mTORC1、mTORC1蛋白在各组大鼠皮层中的表达 |
在p-mTORC1表达高峰时间点(24 h),取注射点周边相同位置皮层用免疫组化法,进一步测定其蛋白的表达。结果显示p-mTORC1主要表达于神经元胞膜,在对照组皮层神经元中呈弱阳性表达,在模型组神经元中高表达(0.33±0.08),表达量较对照组(0.09±0.02)显著增加(P<0.05),而干预组中表达量(0.11±0.03)较模型组显著减少(P<0.05,图 4)。
 |
| A:对照组;B:模型组;C:干预组 图 4 免疫组化检测造模24 h后p-mTORC1在各组大鼠皮层的表达 |
脑外伤后颅内出血,红细胞破裂,铁离子沉积等病理生理改变可使大脑癫痫易感性增加并导致癫痫的发生,因此人们常用FeCl3皮层注射来诱导大鼠发生癫痫[6, 8, 9]。本实验中,我们在大鼠感觉运动皮层注射FeCl3后观察其行为学变化6 h,发现模型组及干预组均有明显癫痫发作,并伴有脑电图的异常痫性放电,与人类PTE发作相似,模型组与干预组造模成功率分别为85.1%和81.6%,再次证明其是一种稳定、可靠的外伤性癫痫动物模型。
mTOR是一种相对保守的非典型丝/苏氨酸蛋白激酶,在控制细胞生长、代谢方面发挥重要作用,当结合不同组分后形成mTORC1和mTORC2两种复合体,其中mTORC1与蛋白合成、细胞分化等有着重要联系,mTORC1在接受上游信号后通过磷酸化调节S6、4EBP1等众多下游分子而参与多种生理病理过程,其在信号通路中处于重要的调控位置。在中枢神经系统中,mTORC1呈低表达状态,起到调节神经元生长分化、突触发生等作用[1]。研究显示:mTORC1在中枢内还具有调控K+、Ca2+等离子通道以及NMDA转运体开放,促进IL-1β等炎性因子释放,调节神经细胞谷氨酸转运体、AMPA、GABA等多种氨基酸受体表达的作用。mTORC1异常活化后将会产生一系列复杂的病理生理改变,使得神经元兴奋性增高、异常细胞同步放电并最终导致癫痫的发生[1, 2, 10, 11]。在脑外伤及PTE动物模型中研究者们均检测到了mTORC1介导的信号通路的持续磷酸化激活,而抑制mTORC1后大鼠癫痫发作的频率及等级均明显减低,同时脑组织中神经元死亡、星形胶质细胞增生及苔藓样纤维出芽等相关的PTE病理改变也明显减少[3]。 本研究发现,对照组大鼠mTORC1的磷酸化程度很低,而模型组mTORC1磷酸化程度则显 著增加,增加的程度与动物癫痫的发 作次数、严重程度呈现出一致性。结合他人的研究,我们有理由认为,mTORC1异常磷酸化激活是启动外伤性癫痫发生、发展重要的信号,是癫痫治疗的重要靶点。目前,一种mTORC1抑制剂作为新型的抗癫痫药已进入临床实验(治疗结节硬化症,常伴难治性癫痫)阶段[12]。
姜黄素是姜黄属植物来源的多酚类单体分子,易穿透血脑屏障,具有抗炎、抗氧化、清除自由基等广泛药理活性[13]。研究发现其对脑梗死、帕金森病、癫痫等多种中枢神经疾病均具有一定的治疗作用。本研究发现,姜黄素可显著减低PTE大鼠的癫痫发作频率和等级,抑制脑皮质异常放电,减少病灶处皮层神经元的 变性、死亡,从行为学、脑电图和细胞超微结构3个层次证明姜黄素对PTE大鼠呈现一定的保护作用。体外研究证实,姜黄素具有抑制mTORC1信号通路作用[14],因此为进一步探究姜黄素发挥抗癫痫效应的机制,我们检测了大鼠脑组织中mTORC1在干预后的磷酸化情况。结果显示,干预组大鼠皮质的mTORC1磷酸化程度处于较低水平,提示姜黄素可能通过抑制mTORC1磷酸化激活而发挥抗癫痫效应。
综上所述,我们认为,mTORC1蛋白的磷酸化激活与PTE的发生有着重要联系。姜黄素在PTE大鼠中表现出良好的抗癫痫作用,其效应机制可能和抑制mTORC1活化有关。总之,mTORC1在外伤性癫痫发生、发展中的具体分子机制以及姜黄素在神经保护效应中的量-效关系都还需要进一步研究。
| [1] | Russo E, Citraro R, Constanti A, et al. The mTOR signaling pathway in the brain: focus on epilepsy and epileptogenesis[J]. Mol Neurobiol, 2012, 46(3): 662-681. |
| [2] | Ryther R C, Wong M. Mammalian target of rapamycin (mTOR) inhibition: potential for antiseizure, antiepileptogenic, and epileptostatic therapy[J]. Curr Neurol Neurosci Rep, 2012, 12(4): 410-418. |
| [3] | Guo D, Zeng L, Brody D L, et al. Rapamycin attenuates the development of posttraumatic epilepsy in a mouse model of traumatic brain injury[J]. PLoS One, 2013, 8(5): e64078. |
| [4] | Jyoti A, Sethi P, Sharma D. Curcumin protects against electrobehavioral progression of seizures in the iron-induced experimental model of epileptogenesis[J]. Epilepsy Behav, 2009, 14(2): 300-308. |
| [5] | Choudhary K M, Mishra A, Poroikov V V, et al. Ameliorative effect of Curcumin on seizure severity, depression like behavior, learning and memory deficit in post-pentylenetetrazole-kindled mice[J]. Eur J Pharmacol, 2013, 704(1/3): 33-40. |
| [6] | 肖淳, 王文, 石全红, 等. STIM1在幼年和成年大鼠外伤性癫痫中的表达[J]. 第三军医大学学报, 2013, 35(14): 1493-1497. |
| [7] | D’Ambrosio R, Fairbanks J P, Fender J S, et al. Post-traumatic epilepsy following fluid percussion injury in the rat[J]. Brain, 2004, 127(Pt 2): 304-314. |
| [8] | 陈敏若, 石全红, 谢延风, 等. 表皮生长因子对铁离子致痫大鼠脑的保护作用[J].第三军医大学学报, 2012, 34(14): 1202-1205. |
| [9] | Pitkanen A, McIntosh T K. Animal models of post-traumatic epilepsy [J]. J Neumtrauma, 2006, 23(2): 241-261. |
| [10] | Galanopoulou A S, Gorter J A, Cepeda C. Finding a better drug for epilepsy: the mTOR pathway as an antiepileptogenic target[J]. Epilepsia, 2012, 53(7): 1119-1130. |
| [11] | Huang X, Zhang H, Yang J, et al. Pharmacological inhibition of the mammalian target of rapamycin pathway suppresses acquired epilepsy[J]. Neurobiol Dis, 2010, 40(1): 193-199. |
| [12] | Wiegand G, May T W, Ostertag P, et al. Everolimus in tuberous sclerosis patients with intractable epilepsy: a treatment option?[J]. Eur J Paediatr Neurol, 2013, 17(6): 631-638. |
| [13] | Sharma R A, Euden S A, Platton S L, et al. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance[J]. Clin Cancer Res, 2004, 10(20): 6847-6854. |
| [14] | Rafiee P, Binion D G, Wellner M, et al. Modulatory effect of curcumin on survival of irradiated human intestinal microvascular endothelial cells: role of Akt/mTOR and NF-κB[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298(6): G865-G877. |



