骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组起源于多能造血干/祖细胞的恶性克隆性疾病,以无效造血、难治性血细胞减少及高风险向急性髓系白血病(acute myeloid leukemia,AML)转化为特征[1]。目前该病发病机制尚不清楚,治疗上采取与白血病相似的治疗手段,但疗效不够理想,临床治愈概率小。细胞遗传学及分子生物学研究已经揭示MDS的造血干、祖细胞存在遗传学异常及相应基因改变,但是仍然不能完全解释MDS疾病的发生[2]。因此,探索 MDS的发病机制,寻找有效的治疗手段具有重要意义。
精子相关抗原6(sperm-associated antigen 6,SPAG6)于1999年被首次成功克隆,因为预测其功能与精子成熟有关而命名。现已证实SPAG6属于肿瘤-睾丸抗原(cancer-testis antigen CTA)家族的一员,可作为肿瘤免疫治疗的潜在靶标[3]。文献[4]报道,采用SNP芯片技术(single nucleotide polymorphism arrays)发现SPAG6基因位于MDS患者10号染色体上的单亲二倍体(uniparental disomy,UPD)区域,而在同一患者对应T细胞中并未出现。同时基因表达谱结果显示SPAG6基因在MDS患者CD34+细胞中表达明显增高[5, 6]。基于以上事实,SPAG6可能作为研究MDS发病机制的重要参选基因。本研究拟应用慢病毒载体介导的短发夹RNA(shRNA)降低人MDS细胞株SKM-1细胞中SPAG6的表达,以探讨SPAG6对SKM-1细胞增殖及凋亡的影响,为下一步阐明SPAG6基因在MDS发生中的作用提供理论依据和奠定实验基础。 1 材料与方法 1.1 材料
慢病毒载体系统,包括pGC-GV载体,质粒pHelper1.0及 pHelper2.0由上海吉凯基因化学技术有限公司提供;T4 DNA连接酶及限制性内切酶 HpaⅠ、XhoⅠ购自NEB公司;DMEM、RPMI1640、胎牛血清(Gibco公司);RNA提取试剂盒、逆转录试剂盒、定量PCR试剂盒(TaKaRa公司);Lipofectamine 2000(Invitrogen公司);质粒抽提试剂盒(Qiagen公司);总蛋白提取试剂盒、BCA蛋白定量试剂盒(Beyotime);兔抗人SPAG6多克隆抗体(Abcam公司);兔抗人GAPDH多克隆抗体、辣根过氧化物酶标记山羊抗兔二抗(Beyotime);SPAG6及GAPDH上下游引物(TaKaRa公司);人MDS 细胞株SKM-1细胞由华中科技大学附属同济医院血液科周剑锋教授馈赠。 1.2 方法 1.2.1 细胞培养
SKM-1细胞和293T细胞分别于含10%胎牛血清和100 U/mL青链霉素的RPMI1640及DMEM完全培养基,37 ℃,5% CO2饱和湿度的培养箱中培养。2~3 d传代1次。取对数期细胞进行实验。 1.2.2 慢病毒载体构建及包装
根据GenBank人SPAG6序列信息,以RNAi在线软件设计3条RNA干扰靶点序列及1条无关序列作为阴性对照(表 1)。根据siRNA靶序列合成双链DNA寡核苷酸,退火形成双链DNA,与HpaⅠand XhoⅠ 双酶切后的线性慢病毒载体连接过夜,转化感受态大肠杆菌DH5α。PCR筛选阳性克隆并进行测序鉴定。常规培养293T细胞,转染前24 h,用胰蛋白酶消化对数生长期的293T细胞,调整细胞数为6×105/mL,待细胞密度达70%~80%时按Lipofectamine 2000使用说明进行共转染293T细胞。转染后48 h收集细胞上清液,将其浓缩得到高滴度的慢病毒浓缩液,分装后保存在病毒管中,-80 ℃长期保存。取其中1支利用逐孔稀释法测定病毒滴度。
| 序列名称 | 靶序列(5′→3′) | GC含量(%) |
| SPAG6-siRNA1 | CATAAAGAATATCCTGCAA | 31.58 |
| SPAG6-siRNA2 | AGCTCATTCTGAGAACCTA | 42.11 |
| SPAG6-siRNA3 | TGATGCTAAATTGAAGCAT | 31.58 |
| NC-siRNA | TTCTCCGAACGTGTCACGT | 52.63 |
取对数期生长的SKM-1细胞均匀接种于6孔板中,每孔细胞数为5×104个,培养24 h。实验分为干扰组及阴性对照组。将SPAG6-shRNA及NC-shRNA慢病毒以感染复数(MOI)值为100分别感染干扰组及阴性对照组细胞,每组均加入终浓度为5 μg/mL的polybrene。培养箱内孵育10 h后更换新鲜培养液,感染后第6天荧光显微镜下观察绿色荧光表达情况,并利用流式细胞术检测SKM-1细胞转染效率。 1.2.4 qRT-PCR检测SPAG6 mRNA的干扰效果
感染后第6天分别收集干扰组及阴性对照SKM-1细胞,TRIzol试剂提取总RNA,按逆转录试剂盒说明书将其反转录为cDNA,利用特异性引物进行定量PCR扩增反应,每组设定3个复孔。SPAG6引物上游: 5′-CCTTTCAGCTCTCAGTCAGGTTTC-3′,下游:5′-TCTTC-ACGTTTCATCCTTGTCCTT-3′,扩增片段长度119 bp;GAPDH引物上游: 5′-CTTTGGTATCGTGGAAGGA-CTC-3′,下游5′-GTAGAGGCAGGGATGATGTTCT3′,扩增片段长度132 bp。扩增条件为:95 ℃预变性30 s,95 ℃变性5 s,62 ℃退火30 s,共进行40个循环。以2-ΔΔCt法计算SPAG6 mRNA的相对表达量。 1.2.5 Western blot检测SPAG6蛋白表达
离心收集各组细胞后,根据总蛋白提取试剂盒说明书加入RIPA及PMSF,冰上裂解30 min,离心收集上清液,BCA测定蛋白浓度。取50 μg总蛋白进行10%的SDS-PAGE电泳后转移到PVDF膜上,用含5%脱脂牛奶TBST封闭液封闭2 h。分别加入1 ∶1 000兔抗人SPAG6抗体和1 ∶1 000兔抗人GAPDH抗体,4 ℃孵育过夜。TBST洗涤3次,共45 min后,与HRP标记的山羊抗兔二抗37 ℃孵育2 h。TBST洗涤,方法同前。ECL化学发光法显色。Quantity One软件分析灰度值,以SPAG6/GAPDH比值表示目的蛋白的相对表达量。 1.2.6 CCK-8法检测细胞增殖
生长状态良好的 SKM-1细胞,调整细胞数为5×103/100 μL,接种于96孔 板中。实验组及对照组分别加入SPAG6-shRNA3及NC-shRNA慢病毒载体。感染后第6天,CCK-8法检测细胞的增殖活性,每孔加入CCK-8试剂10 μL,细胞培养箱内孵育2 h后,在酶标仪450 nm波长处测定D(450)值。并按照公式计算细胞细胞抑制率。
细胞抑制率=[1-实验组D(450)值]/对照组D(450)值×100%。 1.2.7 瑞氏染色观察
感染后第6天收集各组细胞,PBS洗3次,离心弃上清,50 μL PBS重悬,将细胞悬液推片于载玻片上,自然晾干,滴加瑞氏染液后再加入等量的蒸馏水,混匀,静置5 min后,水洗,吸干,镜检观察并采集图像。 1.2.8 流式细胞术检测细胞凋亡
感染后第6天,收集各组细胞,4 ℃PBS洗涤2次后,重悬于Binding buffer 缓冲液中,加入1 μL Annexin V-PE 及 5 μL 7-AAD,避光放置15 min。流式细胞仪分析细胞凋亡。 1.3 统计学方法
采用SPSS 17.0统计软件进行分析,计量资料以x±s 表示,2组间比较采用t检验。 2 结果 2.1 测序结果
将3条重组体阳性克隆分别进行测序,证实构建的慢病毒干扰载体序列插入正确,无序列突变(图 1)。
 |
| SPAG6-shRNA1慢病毒载体;B:SPAG6-shRNA1慢病毒载体;C:SPAG6-shRNA1慢病毒载体;D:NC-shRNA慢病毒载体;横线区域代表干扰靶点序列 图 1 阳性克隆测序结果 |
将SPAG6-shRNA慢病毒载体转人MDS 细胞株SKM-1 后,荧光显微镜下观察可见大量表达绿色荧光细胞,流式细胞术检测转染效率均在60%以上(图 2)。证明SPAG6-shRNA慢病毒载体成功转染了SKM-1 细胞。
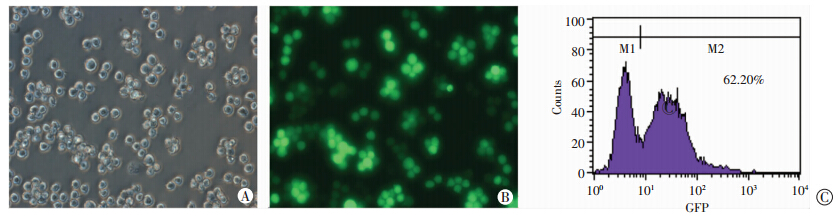 |
| A:干扰组SKM-1细胞白光观察(×40);B:干扰组SKM-1细胞荧光观察(×40);C:流式细胞术检测转染效率 图 2 SPAG6-shRNA慢病毒载体转染SKM-1细胞后第6天 GFP表达及转染效率 |
qRT-PCR检测结果显示,SPAG6-shRNA2及SPAG6-shRNA3慢病毒载体能有效降低SPAG6 mRNA表达水 平[(0.23±0.03),P<0.001;(0.12±0.02),P<0.001]; Western blot检测结果显示,针对3个靶点的SPAG6-shRNA慢病毒载体相对于阴性对照组(0.60± 0.03)均能有效抑制SPAG6蛋白表达[分别为(0.52±0.02),P=0.01;(0.19±0.01),P<0.001;(0.18±0.01),P<0.001],其中SPAG6-shRNA3的基因敲除效率相对最高,确定为最佳靶点(图 3)。
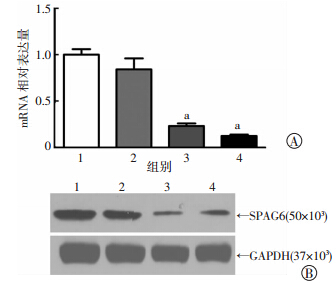 |
| 阴性对照组;2:SPAG6-shRNA1慢病毒干扰组;3:SPAG6-shRNA2慢病毒干扰组;4:SPAG6-shRNA3慢病毒干扰组 A:实时定量RT-PCR检测SPAG6 mRNA表达 a:P<0.05,与阴性对照组比较;B:Western blot检测SPAG6蛋白表达 图 3 SPAG6-shRNA慢病毒的干扰效果验证 |
CCK-8检测结果显示,干扰组细胞增殖变缓,生长明显受到抑制,其抑制率与阴性对照组及空白对照组相比差异有统计学意义(P<0.05,表 2)。
| 组别
| D(450) | 抑制率(%) |
| 空白对照组 | 0.95±0.05 | 0 |
| 阴性对照组 | 0.90±0.02 | 10.70±0.20 |
| 干扰组 | 0.43±0.06 | 60.18±0.37a |
| a:P<0.05,与阴性对照组比较 | ||
倒置相差显微镜下观察干扰组细胞分散,成团现象明显减少,细胞体积变小,可见凋亡小体(图 4A、B)。瑞氏染色显示感染组部分细胞变形,体积变小,胞质边缘不清晰,结构模糊,核膜裂解,核固缩、碎裂 (图 4C、D)。
流式细胞术检测结果显示,感染后第6天,SPAG6-shRNA干扰组SKM-1细胞凋亡率为(16.32±5.8)%,显著高于空白对照组与阴性对照组[(3.08±1.50)%和(4.28±0.88)%,P<0.05,图 4E、F、G],说明SPAG6基因干扰可诱导SKM-1细胞凋亡。
 |
| A:倒置相差显微镜下对照组SKM-1细胞(×40);B:倒置相差显微镜下干扰组SKM-1细胞(×40);C:对照组SKM-1细胞瑞氏染色结果(×40);D:干扰组SKM-1细胞瑞氏染色结果(×40);E~G:流式细胞术检测空白对照组、阴性对照组、干扰组细胞凋亡百分比 图 4 SPAG6基因干扰对SKM-1细胞凋亡的影响 |
目前对SPAG6基因的认识还比较有限,以往研究发现SPAG6可与PF6相互作用维持鞭毛的正常运动[7, 8]。最近研究显示该基因对内耳毛细胞分化有促进作用,在肺癌与乳腺癌患者癌组织中表达明显增高,并将其定义为一种新的肿瘤-睾丸抗原,可作为肿瘤免疫治疗的靶标[9]。肿瘤免疫治疗已经在肿瘤综合治疗中占据重要地位,在MDS治疗方面也取得了一定进展[10, 11]。Steinbach等[12]应用基因芯片技术筛选急性髓系白血病患者高表达基因,发现SPAG6基因与WT1等基因表达明显增高,而在持续完全缓解患者中则接近正常对照水平,提示该基因可能具促癌效应并可作为白血病疗效评估及预后判断的指标。MDS与急性髓系白血病同属于髓系恶性病,结合我们的前期实验发现SPAG6出现在染色体异常的UPD区域,且在MDS患者中表达较正常对照显著增高,由此推测,SPAG6作为促癌基因参与MDS的发生,在MDS发病过程中起着重要作用。目前对SPAG6的研究大都局限于mRNA和蛋白表达水平的检测,而关于SPAG6表达机制及其对肿瘤细胞生物学行为的研究尚少见报道,RNA干扰(RNAi)技术为SPAG6在肿瘤中的进一步研究提供了平台。
RNAi是指与目的基因同源的mRNA被特异的核酸酶降解,诱导特异转录后使目的基因表达沉默的现象。在众多的基因沉默技术中,RNA干扰技术已经被证明是一个强大的抑制特定基因的表达工具,并可用于基因治疗、新药开发及药物靶点筛选等方面的研究。RNAi表达载体包括质粒,腺病毒、慢病毒和逆转录,慢病毒载体可以将外源基因有效地整合至宿主染色体上从而达到持久性表达,且对于原代细胞、悬浮细胞等不易转染的细胞亦有较高的转染效率[13, 14, 15]。本研究采用RNAi技术构建3个SPAG6-shRNA慢病毒载体,成功转染人MDS细胞系SKM-1细胞。利用qRT-PCR及Western blot验证干扰效果,结果显示lenti-SPAG6-shRNA3转染组SPAG6 mRNA及蛋白水平较阴性对照组明显降低,干扰效果明显。进一步研究发现,感染SPAG6-shRNA慢病毒的SKM-1细胞较对照组体外生长明显减缓,细胞早期凋亡明显增加。以上结果说明SPAG6基因可能通过影响细胞的凋亡而促进SKM-1细胞生长。最近有研究报道SPAG6基因可能与TRAIL诱导的凋亡途径有关[16],但其具体对细胞生长的作用机制尚不明确,我们将在后续实验中进一步验证。
综上所述,本研究构建的SPAG6-shRNA慢病毒载体成功降低了SKM-1细胞内SPAG6表达,并证明SPAG6基因具有促进SKM-1细胞生长,抑制其凋亡的影响,有助于阐明MDS发生的分子机制,可望为MDS基因治疗提供新的靶标,为进一步研究SPAG6基因在MDS发生中的作用奠定了实验基础。
| [1] | Cogle C R, Craig B M, Rollison D E, et al. Incidence of the myelodysplastic syndromes using a novel claims-based algorithm: high number of uncaptured cases by cancer registries[J]. Blood, 2011, 117(26): 7121-7125. |
| [2] | Steensma D P, List A F. Genetic testing in the myelodysplastic syndromes: molecular insights into hematologic diversity[J]. Mayo Clin Proc, 2005, 80(5): 681-698. |
| [3] | Silina K, Zayakin P, Kalnina Z, et al. Sperm-associated antigens as targets for cancer immunotherapy: expression pattern and humoral immune response in cancer patients[J]. J Immunother, 2011, 34(1): 28-44. |
| [4] | Wang L, Fidler C, Nadig N, et al. Genome-wide analysis of copy number changes and loss of heterozygosity in myelodysplastic syndrome with del(5q) using high-density single nucleotide polymorphism arrays[J]. Haematologica, 2008, 93(7): 994-1000. |
| [5] | Pellagatti A, Cazzola M, Giagounidis A A, et al. Gene expression profiles of CD34+ cells in myelodysplastic syndromes: involvement of interferon-stimulated genes and correlation to FAB subtype and karyotype[J]. Blood, 2006, 108(1): 337-345. |
| [6] | Sternberg A, Killick S, Littlewood T, et al. Evidence for reduced B-cell progenitors in early (low-risk) myelodysplastic syndrome[J]. Blood, 2005, 106(9): 2982-2991. |
| [7] | Zhang Z, Jones B H, Tang W, et al. Dissecting the axoneme interactome: the mammalian orthologue of Chlamydomonas PF6 interacts with sperm-associated antigen 6, the mammalian orthologue of Chlamydomonas PF16[J]. Mol Cell Proteomics,2005, 4(7): 914-923. |
| [8] | Pearson C G, Giddings T H Jr, Winey M. Basal body components exhibit differential protein dynamics during nascent basal body assembly[J]. Mol Biol Cell, 2009, 20(3): 904-914. |
| [9] | Mulaw M A, Krause A, Deshpande A J, et al. CALM/AF10-positive leukemias show upregulation of genes involved in chromatin assembly and DNA repair processes and of genes adjacent to the breakpoint at 10p12[J]. Leukemia, 2012, 26(5): 1012-1019. |
| [10] | Tada Y, Yoshikawa T, Shimomura M, et al. Analysis of cytotoxic T lymphocytes from a patient with hepatocellular carcinoma who showed a clinical response to vaccination with a glypican-3-derived peptide[J]. Int J Oncol, 2013, 43(4): 1019-1026. |
| [11] | Aggarwal S, van-de-Loosdrecht A A, Alhan C, et al. Role of immune responses in the pathogenesis of low-risk MDS and high-risk MDS: implications for immunotherapy[J]. Br J Haematol, 2011, 153(5): 568- 581. |
| [12] | Steinbach D, Schramm A, Eggert A, et al. Identification of a set of seven genes for the monitoring of minimal residual disease in pediatric acute myeloid leukemia[J]. Clin Cancer Res, 2006, 12(8): 2434-2441. |
| [13] | Matrai J, Chuah M K, VandenDriessche T. Recent advances in lentiviral vector development and applications[J]. Mol Ther, 2010, 18(3): 477-490. |
| [14] | 赵亮, 李静, 魏强, 等. 人PGI基因siRNA慢病毒质粒的构建及对白血病细胞增殖的影响[J]. 第三军医大学学报, 2013, 35(1): 20-23. |
| [15] | 崔浩, 张超, 王攀, 等. 上调基因-4对结肠癌细胞增殖的影响[J]. 中华消化外科杂志, 2012, 11(3): 290-293. |
| [16] | Kranz D, Boutros M. A synthetic lethal screen identifies FAT1 as an antagonist of caspase-8 in extrinsic apoptosis[J]. EMBO J, 2014, 33(3): 181-197. |



