非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确的肝脏损伤因素所致的以肝细胞脂肪变性为主要特征的临床病理综合征。亚太地区成人NAFLD患病率约为20%[1],已接近欧美发达国家的水平[2]。NAFLD由于其较高的发病率和与终末期肝病(如肝硬化和肝癌)密切相关,近年来引起学者们的高度关注。
泛素化修饰是指泛素分子在泛素激活酶E1、泛素结合酶E2和泛素连接酶E3的作用下,通过共价连接至底物蛋白赖氨酸残基上的过程,是一种重要的蛋白质转录后修饰方式。被泛素分子修饰的蛋白随后便循泛素-蛋白酶体途径,进一步被蛋白酶体中的多种蛋白酶分解,而泛素分子重新变为游离形式释放,是蛋白质降解的主要方式。
ZCWCC1(Zinc-finger CW-type coiled-coil protein 1) 蛋白最初在一种以小睾丸为表型的遗传疾病中被发现,与生精作用、DNA甲基化及异染色质形成相关[3, 4, 5]。而新近的研究发现ZCWCC1在前脂肪细胞的细胞浆中通过上调柠檬酸裂解酶磷酸化修饰程度来调控其活性[6],因前脂肪细胞分化与肝细胞脂肪变性均有成脂基因的激活、脂肪蓄积等共性,故本研究拟在L02肝细胞脂肪变性过程中观察ZCWCC1蛋白的表达变化,并初步探讨其变化机制,以期为肝细胞脂肪变性乃至NAFLD的发生、发展机制的阐明提供实验依据。 1 材料与方法 1.1 材料
L02肝细胞(HL-7702)购自中国科学院上海细胞库,高糖DMEM培养基、胎牛血清、0.25%胰蛋白酶购自HyClone公司,无游离脂肪酸的BSA购自BioChem公司,油酸、Triton X-100、油红、N-乙基马来酰亚胺(N-Ethylmaleimide,NEM)、MG132购自Sigma-Aldrich公司,细胞甘油三酯含量测定试剂盒购自北京普利莱公司,细胞核浆蛋白提取试剂盒、SDS-PAGE凝胶配制试剂盒购自碧云天公司,蛋白浓度测定试剂盒购自Bio-Rad公司,兔抗人ZCWCC1抗体购自Bethyl laboratories公司,TRIzol试剂、RIPA裂解液、DAPI染料、BODIPY染料、Alexa594红色荧光标记的山羊抗兔抗体均购自Life techologies公司,反转录试剂盒及荧光定量PCR试剂盒(SYBR Green)购自TaKaRa公司,0.22 μm孔径的PVDF膜及ECL化学发光试剂盒购自Millipore公司,山羊血清封闭液、鼠抗人β-actin、HRP标记的山羊抗鼠及抗兔IgG抗体购自中杉金桥公司。 1.2 方法 1.2.1 细胞培养
L02肝细胞常规培养于含10% FBS和1%青链双抗的高糖DMEM培养基中,孵箱温度为37 ℃,湿度95%。每2~3天传代,取对数生长期细胞进行实验。 1.2.2 L02肝细胞分组及脂肪变性模型的建立
取对数生长期的L02肝细胞,以1×105/孔铺于6孔板上,待其贴壁后,以不含FBS的高糖DMEM培养基饥饿过夜。对照组及诱导组细胞均以含1%无游离脂肪酸BSA的高糖DMEM培养基(事先已无菌过滤)培养,其中诱导组中加入无菌过滤的油酸储存液,使油酸终浓度为500 μmol/L。实验分组:将L02肝细胞分为对照组与不同时间点的脂肪变性组(3、6、12、24、48 h);为了明确泛素化是否参与了ZCWCC1的降解过程,加用NEM提取蛋白时分为对照组、NEM 组。为了明确蛋白酶体有无参与ZCWCC1在L02肝细胞脂肪变性过程中的降解,诱导脂肪变性加入MG132处理,分为对照组、诱导组、 MG132 组、MG132+诱导组。 1.2.3 油红染色
将L02肝细胞铺于直径10 cm的平皿上或以3×104/孔铺于预先放置无菌盖玻片的24孔板上。诱导结束后将培养基倒去,10%多聚甲醛固定15 min,浓度为3 g/L的油红37 ℃染色12 min,再用苏木精染液染色5 min,上述各步之间均以PBS清洗3次,最后置于显微镜下观察及采集图像。 1.2.4 细胞甘油三酯含量测定
将对照组与诱导组L02肝细胞培养基去除后,PBS清洗细胞3次,6孔板中每孔加入100 μL含蛋白酶抑制剂的RIPA裂解液,冰上裂解1 h后7 000 r/min离心5 min,取5 μL上清进行蛋白浓度测定,余下上清70 ℃加热10 min后取30 μL,加入190 μL显色液在37 ℃孵育10 min,在波长550 nm处测定光密度值[D(550)],按标准曲线计算甘油三酯含量后,除以蛋白浓度,即得到标化的细胞甘油三酯含量。 1.2.5 免疫荧光及激光共聚焦显微镜检测
将L02肝细胞以2×104/孔种于激光共聚焦检测专用小皿中进行诱导处理后,弃去培养基,4%多聚甲醛固定15 min,随后加入0.3% Triton X-100通透15 min,山羊血清封闭液37 ℃封闭1 h,1 ∶250的ZCWCC1抗体4 ℃ 孵育过夜,加入Alexa594红色荧光标记的山羊抗兔抗体37 ℃孵育1 h,BODIPY染料染色5 min,DAPI染色5 min后用防淬灭甘油封片剂进行封片,上述各步之间均以PBS清洗3次。最后将样品置于Carl Zeiss激光共聚焦显微镜下观察并采图。 1.2.6 细胞总RNA提取与荧光定量PCR
将对照组与诱导组L02肝细胞培养基去除后,PBS清洗细胞3次,按TRIzol试剂说明书操作提取细胞总RNA,并按反转录试剂盒说明书以30 μL体系将1 μg 各组RNA反转录为cDNA。随后按照TaKaRa SYBR Green一步法定量PCR试剂盒说明书操作,进行荧光定量PCR检测,体系为25 μL,95 ℃预温5 min,随后进行95 ℃ 5 s和60 ℃ 30 s共40个循环的扩增,最后72 ℃延伸2 min,并进行溶解曲线的测定。引物序列:ZCWCC1正义链:5′-GGAGGTTCCTTCTCCCAAAGTC-3′,反义链:5′-CAGAAACTGCGACACTCCGCTT-3′,产物长度110 bp;β-actin正义链:5′-CCACGAAACTACCTTCAA-CTCC-3′,反义链:5′-GTGATCTCCTTCTGCATCCTGT-3′,产物长度132 bp。结果以Ct值表示,β-actin为内参照,以2-ΔΔCt计算基因相对表达量。 1.2.7 细胞总蛋白提取与Western blot检测
蛋白提取均在4 ℃进行,按碧云天公司细胞核浆蛋白提取试剂盒说明书进行操作。提出的L02肝细胞胞核及胞浆蛋白中加入5倍于工作浓度的loading buffer储存液并煮沸5 min,测定浓度。照SDS-PAGE凝胶配制试剂盒说明配制浓缩胶及10%分离胶。每孔上样量为50 μg,电泳电压:浓缩胶60 V,分离胶110 V;随后将蛋白以100 V、1.5 h的条件转至0.22 μm孔径的PVDF膜上,5%脱脂奶粉室温封闭2 h后一抗4 ℃孵育过夜 (ZCWCC1抗体稀释比例为1 ∶5 000,β-actin为1 ∶1 000) ,TBST洗膜10 min×3次后室温孵育二抗 2 h,再以TBST洗膜3次,ECL显影。以β-actin为内参。 1.3 统计学处理
使用Bio-Rad iQ5软件分析荧光定量PCR结果,使用Image J软件计算Western blot条带灰度值。数据采用SPSS 18.0统计软件进行分析,结果以x±s表示,采用t检验进行两组间均数比较,采用单因素方差分析与LSD法进行多组间均数比较。 2 结果 2.1 L02肝细胞脂肪变性模型的建立与鉴定
大体观察时,与对照组比较,诱导组L02肝细胞油红染色较深(图 1A)。镜下观察,油红染色阳性的脂滴蓄积在细胞质中,对照组细胞的细胞浆中偶见脂滴(图 1B),诱导组细胞的细胞浆中充满大量脂滴,围绕细胞核分布,且部分脂滴发生融合(图 1C)。以蛋白浓度标化的细胞甘油三酯含量测定显示,诱导24 h后L02肝细胞内甘油三酯含量较诱导前明显上升[分别为(45.43±8.76)、(180.61±28.93),P<0.01]。结果表明L02肝细胞脂肪变性模型已成功建立,可用于进行后续实验。
 |
| A:大体观察;B:对照组(×400);C:诱导组(×400) 图 1 L02肝细胞脂肪变性模型的建立(油红染色) |
免疫荧光标记技术及激光共聚焦显微镜检测结果显示,随着诱导时间的延长,点状堆积在细胞核周围、BODIPY染色阳性的脂滴逐渐增多,而Alexa594红色荧光标记,主要分布在细胞核中的ZCWCC1蛋白在3、6、12 h 3个时间点上较对照组(0 h)无明显变化,但在诱导24 h后其荧光强度较前4个时间点明显下降(图 2)。在延长诱导时间至48 h时Western blot检测结果显示,ZCWCC1主要出现在胞核蛋白中,而胞浆蛋白中的含量较少。在0、3、6、12、24、48 h 6个时间点中,胞核中ZCWCC1蛋白含量在前4个时间点无明显 变化[(56 283±303)、(56 753±539)、(55 561±996)、(56 257± 326),P=0.200],而诱导第24、48小 时的表达水平 较前显著降低[(48 339±712),(43 022± 2 198),P<0.01];细胞浆中的少量ZCWCC1蛋白则无上述趋势(图 3)。
 |
| 图 2 免疫荧光标记结合激光共聚焦观察ZCWCC1蛋白在L02肝细胞脂肪变性不同时间点的含量变化(×630) |
 |
| 1~6:胞浆蛋白;7~12:胞核蛋白;1、7:对照组;2~6、8~12:诱导组;2、8:3 h;3、9:6 h;4、10:12 h;5、11:24 h;6、12:48 h 图 3 Western blot检测L02肝细胞脂肪变性不同时间点核浆蛋白中ZCWCC1的含量变化 |
荧光定量PCR检测结果显示,ZCWCC1的mRNA水平在诱导前后并无明显变化[(22.39±0.51)、(22.35±0.42),P=0.86]。UbiPred网站(http://iclab.life.nctu.edu.tw)及UbiProber软件上的预测结果显示,在ZCWCC1蛋白的氨基酸序列中有9个可能性在80%以上的泛素化修饰位点,提示ZCWCC1蛋白很有可能被泛素化修饰(表 1)。在正常培养未经脂肪变性诱导的L02肝细胞中,加用10 mmol/L的NEM提取蛋白可通过维持泛素分子与ZCWCC1的结合,增加其降解(图 4A),结果具有统计学差异[(59 035±2 390)、(68 211±2 985),P=0.014]。
| 编号 | 可能被泛素化的赖氨酸位置 | 侧翼序列 | 得分 |
| 1 | 51 | YGNGLKSGSMRIG-K-DFILFTKKEDTMT | 0.871 2 |
| 2 | 302 | RIKEAKQRALKEP-K-ELNFVFGVNIEHR | 0.878 9 |
| 3 | 372 | LEPTHNKQDFADA-K-EYRHLLRAMGEHL | 0.862 3 |
| 4 | 493 | KQKVPLGTFRKDM-K-TQEEKQKQLTEKI | 0.915 9 |
| 5 | 518 | KIRQQQEKLEALQ-K-TTPIRSQADLKKL | 0.842 8 |
| 6 | 660 | VPSPKVIKTPVVK-K-TESPIKLSPATPS | 0.839 9 |
| 7 | 666 | IKTPVVKKTESPI-K-LSPATPSRKRSVA | 0.826 3 |
| 8 | 727 | LSDSAGEEDSADL-K-RAQKDKGLHVEVR | 0.879 8 |
| 9 | 765 | AVEVGKHVVRWKV-K-FDYVPTDTTPRDR | 0.936 9 |
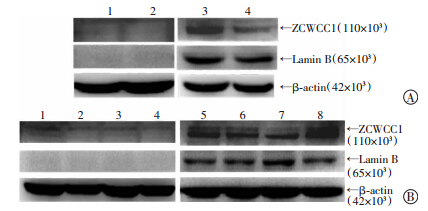 |
| A:NEM在提取未经脂肪变性诱导的L02肝细胞时对ZCWCC1蛋白降解的影响 1、2:胞浆蛋白;3、4:胞核蛋白;1、3:对照组;2、4:NEM组; B:MG132对L02肝细胞脂肪变性诱导中ZCWCC1蛋白含量变化的影响 1~4:胞浆蛋白;5~8:胞核蛋白;1、5:对照组;2、6:MG132组;3、7:诱导组;4、8:MG132+诱导组 图 4 Western blot检测各组L02肝细胞中ZCWCC1蛋白水平的变化 |
诱导L02肝细胞脂肪变性时若加用浓度为 1 μmol/L 的MG132,可逆转ZCWCC1蛋白原先的下降趋势(图 4B),结果具有统计学差异[分别为(136 358± 3 451)、(153 011±3 790),P=0.005]。以上两项结果提示泛素-蛋白酶体途径参与了ZCWCC1 在L02肝细胞脂肪变性过程中的降解。 3 讨论
关于非酒精性脂肪性肝病的发生机制,较为经典的理论是Day[7]提出的“二次打击学说”,其中肝细胞内甘油三酯蓄积作为“第一次打击”,是后续事件的始动环节,但影响该环节的因素仍未得到完全阐明。油酸是高脂饮食中最重要的两种脂肪酸之一,也是本实验中诱导肝细胞脂肪变性的主要试剂[8]。油酸进入肝细胞后,以甘油为骨架合成甘油三酯并蓄积。甘油三酯的蓄积与脂肪酸摄取及从头合成水平、甘油三酯和脂肪酸氧化水平、甘油三酯的转运和分泌状态等多种因素有关,以上各个环节均受到一系列转录因子的调控,其中任一环节的稳态失衡,都可能是肝细胞中脂质沉积的原因[9]。ZCWCC1作为一种核转录因子,并且可在前脂肪细胞的分化过程中发挥作用[6],而前脂肪细胞分化的分子机制与肝细胞脂肪变性类似,故研究ZCWCC1是否参与肝细胞脂肪变性的形成过程具有重要意义。
本实验通过免疫荧光及蛋白免疫印迹两种检测手段,发现ZCWCC1主要定位在L02肝细胞的细胞核中,是由于ZCWCC1蛋白包含一段核内定位序列[10],在细胞质中合成后被转运至细胞核内的结果。同时我们还发现,在L02肝细胞脂肪变性诱导过程中,诱导24 h之前核内的ZCWCC1并无明显变化,可能是由于在此时间段内L02肝细胞脂肪变性程度较轻所致。诱导24 h后,L02肝细胞核内的ZCWCC1蛋白水平出现了明显下调,提示ZCWCC1有可能参与了脂肪蓄积的过程。但本结果与Sanchez-Solana等[6]在前脂肪细胞株3T3-L1中的发现并不完全相同,后者发现ZCWCC1在细胞质中通过使柠檬酸裂解酶的S455残基磷酸化来调控该酶的成脂活性,但细胞核中并无明显变化。我们考虑在L02肝细胞中,ZCWCC1也有可能通过另外的方式来影响脂质蓄积。
本实验发现L02肝细胞核中ZCWCC1的蛋白表达水平下降,原因可能有以下两种:①ZCWCC1的转录水平受到某种上游因素的影响,mRNA水平下降导致了蛋白水平的降低;②ZCWCC1蛋白降解增强,从而导致其蛋白含量下降。但对mRNA水平的检测结果显示,脂肪变性诱导前后ZCWCC1在转录水平并无明显变化,提示其降解在此过程中发挥了主要作用。而且,本实验中使用了赖氨酸蛋白酶抑制剂NEM,保护已结合至ZCWCC1赖氨酸残基上的泛素蛋白在细胞蛋白提取过程中不被水解脱落,通过维持其泛素化,而增加ZCWCC1的降解,提示ZCWCC1蛋白可发生泛素化修饰,并且泛素化修饰参与了其降解。泛素化修饰的蛋白是在蛋白酶体中被降解的,本实验中使用蛋白酶体抑制剂MG132抑制蛋白酶体功能后,可逆转ZCWCC1在L02肝细胞脂肪变性中的下降趋势,提示蛋白酶体也同时参与了ZCWCC1的降解过程。以上两个实验结果分别从泛素化修饰及蛋白酶体降解的两个层面证明,ZCWCC1在L02肝细胞脂肪变性诱导过程中的蛋白水平下降与泛素-蛋白酶体途径有关。在ZCWCC1蛋白的氨基酸序列上,同时具有核定位信号与核输出信号,其中前者可使ZCWCC1在细胞浆合成后转运入核。结合胞内定位以及免疫荧光的结果,推测在脂肪蓄积的过程中,ZCWCC1受到某些上游事件的触发,ZCWCC1蛋白的核输出信号被激活,ZCWCC1蛋白得以由核孔进入细胞浆并被泛素化修饰,最终进入蛋白酶体中降解[10]。但触发ZCWCC1蛋白胞内转运的具体机制仍未完全清楚,尚需要更多的研究来阐明。
在ZCWCC1蛋白的氨基酸序列中,还包含一段锌指结构[10],因锌指结构可与DNA结合,加之其主要定位于细胞核内,故ZCWCC1蛋白有可能通过改变下游基因表达而发挥作用。Moissiard等[5]发现,ZCWCC1与异染色质及基因沉默有关;Shao等[11]进一步发现,ZCWCC1可与组蛋白去乙酰化酶HDAC4共同结合在下游基因的转录调控区,通过降低组蛋白的乙酰化程度来负性调控下游基因,是一种抑制性的转录因子。结合本实验中ZCWCC1在成脂诱导后蛋白表达降低的结果,从而进一步提示其可能通过转录因子的角色参与了肝细胞的脂肪蓄积过程,但本假设及ZCWCC1与脂质蓄积相关的下游基因仍需通过进一步实验来验证。
本研究表明,ZCWCC1蛋白在L02肝细胞中主要定位于核内,在细胞脂肪变性过程中通过泛素-蛋白酶体途径降解。结合其抑制性核转录因子的特征,推测其可能通过以下方式参与成脂过程:在脂肪变性过程中,由于ZCWCC1的降解,失去对成脂基因的抑制性调控,使后者表达增加,脂肪合成上调、分解减少,从而蓄积在肝细胞的细胞浆内,引发“第一次打击”。本研究结果提示ZCWCC1可能是非酒精性脂肪性肝病的1个潜在的干预靶点,值得深入研究。
| [1] | Speliotes E K, Massaro J M, Hoffmann U, et al. Fatty liver is associated with dyslipidemia and dysglycemia independent of visceral fat: the Framingham Heart Study [J] . Hepatology, 2010, 51(6): 1979-1987. |
| [2] | Bellentani S, Scaglioni F, Marino M, et al. Epidemiology of non-alcoholic fatty liver disease [J]. Dig Dis, 2010, 28(1): 155-161. |
| [3] | Inoue N, Hess K D, Moreadith R W, et al. New gene family defined by MORC, a nuclear protein required for mouse spermatogenesis [J]. Hum Mol Genet, 1999, 8(7): 1201-1207. |
| [4] | Liu Z W, Shao C R, Zhang C J, et al. The SET domain proteins SUVH2 and SUVH9 are required for Pol V occupancy at RNA-directed DNA methylation loci [J]. PLoS Genet, 2014, 10(1): e1003948. |
| [5] | Moissiard G, Cokus S J, Cary J, et al. MORC family ATPases required for heterochromatin condensation and gene silencing[J]. Science, 2012, 336(6087): 1448-1451. |
| [6] | Sanchez-Solana B, Li D Q, Kumar R. Cytosolic functions of MORC2 in lipogenesis and adipogenesis[J]. Biochim Biophys Acta, 2014, 1843(2): 316-326. |
| [7] | Day C P. Pathogenesis of steatohepatitis[J]. Best Pract Res Clin Gastroenterol, 2002, 16(5): 663-678. |
| [8] | Ricchi M, Odoardi M R, Carulli L, et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes[J]. J Gastroenterol Hepatol, 2009, 24(5): 830-840. |
| [9] | Berlanga A, Guiu-Jurado E, Porras J A, et al. Molecular pathways in non-alcoholic fatty liver disesas[J]. Clin Exp Gastroenterol, 2014, 7: 221-239. |
| [10] | Wang G L, Wang C Y, Cai X Z, et al. Identification and expression analysis of a novel CW-type zinc finger protein MORC2 in cancer cells[J]. Anat Rec (Hoboken), 2010, 293(6): 1002-1009. |
| [11] | Shao Y, Li Y, Zhang J, et al. Involvement of histone deacetylation in MORC2-mediated down-regulation of carbonic anhydrase Ⅸ[J]. Nucleic Acids Res, 2010, 38(9): 2813-2824. |



