自体软骨移植是一种治疗软骨缺损的理想方法。与传统手术相比,自体软骨移植的患者能获得长期预后和更高的功能要求。但由于自体软骨来源有限且术中取材易导致创伤,该技术的推广应用受到了限制[1]。目前采用基因诱导间充质干细胞(mesenchymal stem cells,MSCs)成软骨分化,构建“生物工程软骨”有望弥补这些不足,该领域已成为软骨修复的研究热点[2]。骨形态蛋白2(bone morphogengetic protein 2,BMP2)是目前公认的诱导MSCs成软骨分化的良好而又安全的诱导因子[3, 4]。然而BMP2在诱导MSCs成软骨的同时还上调了不利于成软骨的因子,如上调了软骨抑制因子Smad7(mothers against decapentaplegic homolog 7),它可破坏成软骨进程以及软骨细胞的稳定性[5, 6]。因此,联合应用其他因子去增强BMP2成软骨效应,可能是消除这一不利因素的有效策略。本课题组前期研究发现了一个“增强因子”——人性别决定区Y框蛋白9(sex determing region Y-related high mobility group-box gene 9,Sox9)可在明显增强BMP2诱导成软骨进程的同时,抑制软骨细胞骨化,但单独运用Sox9却不能发挥这些作用,其作用机制不明[7]。本研究拟初步探明Smad7是否是Sox9协同BMP2成软骨的作用靶点之一,即Sox9增强BMP2成软骨效应是否与其下调Smad7有关,以期为揭示BMP2基因强化生物工程软骨的机制和临床应用奠定基础。 1 材料与方法 1.1 细胞与重组腺病毒
采用小鼠骨髓间充质干细胞株(C3H10T1/2)以及人胚肾293细胞株(HEK293),重组腺病毒Ad-BMP2、Ad-Sox9,对照重组腺病毒Ad-GFP均由美国芝加哥大学分子肿瘤研究室主任何通川教授惠赠。 1.2 主要试剂
胎牛血清(FBS)购自Bionid公司,DMEM培养基和胰蛋白酶均购自HyClone公司,青链霉素、蛋白酶抑制剂(PMSF)、细胞裂解液、鼠单克隆GAPDH抗体、SDS蛋白上样缓冲液、辣根过氧化物酶标记山羊抗小鼠IgG抗体等均购自上海碧云天生物技术有限公司,TRIzol试剂购自美国Invitrogen公司,逆转录试剂盒、SYBR Green Supermix购自美国Bio-Rad公司,Real-time PCR引物皆由上海生工公司合成,引物序列参见表 1。鼠单克隆抗体Smad7购自美国Santa Cruz公司,辣根过氧化物酶标记山羊抗兔IgG抗体购自美国Abcam公司,免疫细胞化学试剂盒购自北京中杉金桥生物有限公司。
| 基因 | 引物序列(5′→3′) | 片段大小(bp) |
| Sox9 | 正义链:AGCTCACCAGACCCTGAGAA | 200 |
| 反义链:TCCCAGCAATCGTTACCTTC | ||
| BMP2 | 正义链:ACCAGACTATTGGACACCAG | 174 |
| 反义链:AATCCTCACATGTCTCTTGG | ||
| Smad7 | 正义链:AAGATCGGCTGTGGCATC | 230 |
| 反义链:CCAACAGCGTCCTGGAGT | ||
| OPN | 正义链:CCTCCCGGTGAAAGTGAC | 124 |
| 反义链:CTGTGGCGCAAGGAGATT | ||
| MMP13 | 正义链:GGAGCATGGCGACTTCTAC | 208 |
| 反义链:GAGTGCTCCAGGGTCCTT | ||
| GAPDH | 正义链:CTACACTGAGGACCAGGTTGTCT | 123 |
| 反义链:TTGTCATACCAGGAAATGAGCTT |
采用浓度为10%胎牛血清和1%青链霉素的DMEM培养基,在75 cm2细胞培养瓶中培养HEK293细胞,待细胞汇合度达60%~70%时加入适量腺病毒感染。4~5 d后,荧光显微镜下可见带有荧光的细胞比率接近90%,显微镜下观察HEK293细胞变圆,有40%~50%细胞脱落漂浮后,收集细胞悬液并低速离心,弃去上清液,在液氮与37 ℃水浴中反复冻融,裂解细胞,然后高速离心后收集细胞裂解液上清,测试病毒滴度后并保存。 1.3.2 C3H10T1/2细胞的培养及诱导分化
C3H10T1/2细胞用含10%胎牛血清和1%青链霉素的完全培养基在75 cm2细胞培养瓶中进行培养,待细胞生长至30%~40%时(传代后约24 h),分为等量4组,分别加入适量Ad-GFP、Ad-BMP2、Ad-Sox9、Ad-BMP2+Ad-Sox9 病毒悬液感染细胞,以4组间具有相同荧光强度,且细胞生长状态良好作为病毒用量,感染24 h后在荧光显微镜下观察,一般感染率控制在40%~50%。 1.3.3 细胞总RNA的提取
按1.3.2的方法在6孔板中培养细胞,培养至所需时间,弃去培养液。用PBS清洗2次后,每孔加入1 mL TRIzol试剂,反复吹打5 min使细胞充分裂解,将混合液移至1.5 mL EP管,室温放置5 min后加入200 μL氯仿,剧烈振荡15 s,室温放置3 min。4 ℃低温离心,13 000 r/min,15 min。吸取上清加入600 μL异丙醇混匀,室温放置10 min。4 ℃低温离心,13 000 r/min,10 min,管底可见白色沉淀,吸弃上清,加入75%乙醇1 mL洗涤沉淀。4 ℃低温离心,10 000 r/min,5 min,弃上清,待其空干,加入25 μL DEPC水溶解RNA,检测RNA浓度。 1.3.4 RNA逆转录反应体系
将总RNA 500 ng、5×Iscript反应缓冲液2 μL、Iscript逆转录酶0.5 μL加入EP管,nuclease freewater 补足至10 μL。PCR设定反应条件:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃ 保持。 1.3.5 Real-time PCR
按1.3.2的方法在6 孔板中培养C3H10T1/2 细胞,分别于第3、7、11天提取细胞总RNA,逆转录后行Real-time PCR,检测第3、7、11天 Smad7与11 d OPN与基质金属蛋白酶13(MMP13)mRNA相对表达水平。反应体系:95 ℃ 3 min;95 ℃ 10 s,58 ℃ 5 s,40次;58~95 ℃每次上升0.5 ℃绘制溶解曲线。GAPDH做内参,每次反应设3个平行复孔和无模板阳性对照(NTC),NTC未出现特异性扩增曲线。 1.3.6免疫细胞化学染色
按1.2.2的方法在24孔板中培养C3H10T1/2细胞,诱导分化11 d后,弃去培养基,PBS清洗细胞2次后,4%多聚甲醛固定30 min,之后按免疫细胞化学试剂盒说明行Smad7免疫细胞化学染色。 1.3.7 Western blot检测
按1.2.2的方法在6孔板中培养C3H10T1/2细胞,到达计划时间时,分别收集3 d BMP2组、Sox9组与7 d Ad-BMP2、Ad-Sox9、Ad-BMP2+Ad-Sox9、Ad-GFP细胞并提取总蛋白,采用BCA蛋白浓度测定法测定所获得的蛋白浓度。经SDS-PAGE蛋白电泳(每孔上样量约60 μg总蛋白)、半干转印、5%脱脂奶粉封闭1 h、4 ℃摇床孵育目标一抗过夜、洗膜、室温孵育二抗2 h后,化学发光检测,使用Quantity One软件进行图像采集。 1.4 统计学处理
计量资料以x±s表示,采用SPSS 19.0统计软件进行随机区组设计的方差分析,组间两两比较t检验。 2 结果 2.1 重组病毒感染间充质干细胞后目的基因表达
24 h后,Ad-BMP2、Ad-Sox9、Ad-BMP2+Ad-Sox9及Ad-GFP感染C3H10T1/2的感染率达40%~50%,细胞生长状态良好,可持续至感染后11 d(图 1),表明重组腺病毒可有效感染C3H10T1/2。Western blot检测结果表明,目的基因BMP2、Sox9 均成功转入C3H10T1/2细胞并可稳定有效表达(图 2)。
 |
| A:BMP2组;B:Sox9组;C:GFP组 图 1 Ad-BMP2、Ad-Sox9及Ad-GFP感染C3H10T1/2细胞后的荧光蛋白表达 (荧光显微镜 ×100) |
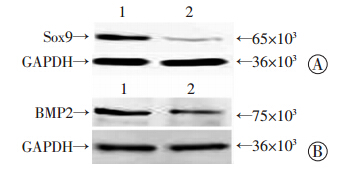 |
| A:Sox9蛋白表达 1: Sox9组;2:GFP组;B: BMP2蛋白表达 1:BMP2组;2:GFP组 图 2 Western blot检测各组重组腺病毒感染C3H10T1/2细胞目的蛋白表达水平 |
相应的重组病毒感染C3H10T1/2后,检测发现在BMP2组(3、7、11 d)与BMP2+Sox9组(3、7 d)中,其Smad7 mRNA表达水平均明显高于同时间点 GFP组(P<0.05)。第7、11天,BMP2+Sox9组Smad7 mRNA 表达明显低于BMP2组(P<0.05),提示高表达Sox9可有效抑制BMP2上调的Smad7 mRNA表达。以上结果表明,BMP2在诱导成软骨进程的同时上调了Smad7,联用Ad-Sox9后,高表达Sox9可有力抑制Smad7 mRNA的表达,其中7、11 d效果最明显(P<0.05,图 3)。
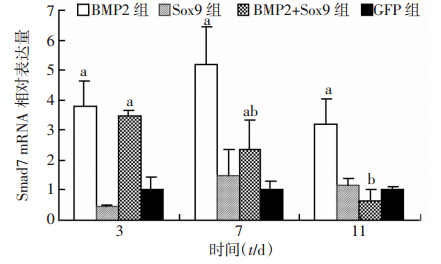 |
| a:P<0.05,与同时间GFP组比较;b:P<0.05,与同时间BMP2组比较 图 3 Real-time PCR检测 Sox9和BMP2对Smad7 mRNA 表达水平的影响 |
相应的重组腺病毒感染C3H10T1/2细胞第7天,与GFP组相比,BMP2组Smad7蛋白表达明显升高;而BMP2+Sox9组中Smad7蛋白表达明显弱于BMP2组;Sox9组染色深度与GFP组比无显著差异,但显著低于BMP2组和BMP2+Sox9组。免疫细胞化学染色与Western blot检测获得相似的结果(图 4、5),表明Sox9可在蛋白水平抑制BMP2诱导下的Smad7高表达。
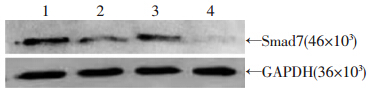 |
| 1:BMP2组;2:Sox9组;3:BMP2+Sox9组;4:GFP组 图 4 Western blot检测感染第7天时各组Smad7蛋白表达水平 |
 |
| A:BMP2组;B:Sox9组;C:BMP2+Sox9组;D:GFP组 图 5 免疫细胞化学染色观察感染第7天时各组Smad7表达情况 (S-P ×200) |
重组腺病毒感染C3H10T1/2后,提取7 d样本中mRNA,逆转录后行Real-time PCR,检测结果显示,BMP2组OPN基因水平表达明显高于GFP组(P<0.05),而BMP2+Sox9组中OPN表达量明显低于BMP2组(P<0.05)。MMP13在BMP2组中表达明显低于GFP组(P<0.05),而BMP2+Sox9组比BMP2组中MMP13表达更低(P<0.05,图 6)。这表明Sox9显著抑制BMP2诱导下OPN的表达,并协同BMP2抑制了MMP13的表达。
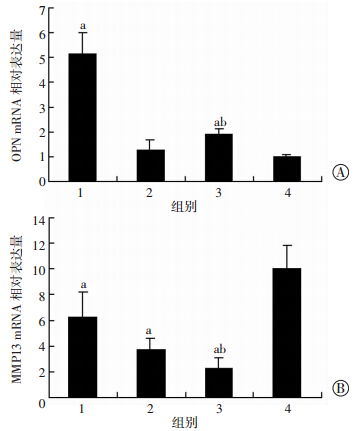 |
| 1:BMP2组;2:Sox9组;3:BMP2+Sox9组;4:GFP组 a:P<0.05,与GFP组比较;b:P<0.05,与BMP2组比较 图 6 Real-time PCR检测Sox9和BMP2对OPN(A)与MMP13(B) mRNA表达水平的影响 |
由于软骨组织缺乏血液供应,自我修复能力弱,临床传统的治疗方法不能为软骨缺损患者提供长期良好的预后。软骨移植技术,尤其是自体软骨移植虽然可提供良好的预后,但因软骨来源不足和创伤性取材,临床应用受到限制。基因强化的“生物工程软骨”可为软骨移植提供充足的修复材料,已成为研究热点。
BMP2因可有效地诱导MSCs成软骨分化而受到广泛关注。如在裸鼠皮下注射感染了Ad-BMP2的MSCs,可形成软骨结节[7],而BMP2敲除鼠则无法形成正常软骨[8]。Jain等[9]也进一步研究证明了BMP2诱导成软骨的能力。此外BMP2已被美国FDA批准应用于脊柱手术中,其生物安全性已得到保证,因此BMP2在构建生物工程软骨方面具有广阔的应用前景。但BMP2在诱导软骨分化的同时也诱导了MSCs成骨进程[10],并且上调了一系列抑制软骨形成的因子,从而阻碍了软骨的分化与稳定。故通过联合运用其他因子,去除或减弱以上不良因素,增强BMP2成软骨效应,可能是优化BMP2诱导的“生物工程软骨”的好方法。
我们前期研究发现,联合应用Sox9可有效提高BMP2成软骨能力,增强Col2al和Aggrean等一系列成软骨因子表达,在强化BMP2诱导软骨化的同时抑制了成骨因子表达,维持软骨稳定表型[7],然而其作用机制尚不明确。Smad7作为BMP2下游的重要软骨抑制因子,在BMP2诱导下表达明显升高,在软骨化进程中起到了重要作用[3]。Smad7能通过阻断Smad1/5/8通路与MAPK通路抑制BMP2诱导的软骨化进程。高表达Smad7的小鼠,其软骨化进程受到完全抑制,说明Smad7可有效抑制干细胞软骨分化[10]。而敲除Smad7后小鼠生长板中软骨细胞最终成熟障碍,肥大区域加大,软骨细胞分化停滞,说明Smad7在软骨细胞最终分化中起到了重要作用[11]。研究发现,高表达Sox9可增强BMP2成软骨,同时抑制软骨细胞骨化,减小生长板肥大区域[7]。这一系列现象提示Smad7可能是Sox9协同BMP2成软骨的作用靶点之一。研究不同表达水平Smad7对BMP2诱导软骨化进程的影响将有利于进一步了解Smad7的作用。然而由于同时采用腺病毒表达Smad7,Sox9与BMP2细胞模型难以维持。Iwai等[10]研究发现高表达的Smad7可通过抑制Smad1/5/8与P38通路有力阻断BMP2诱导的软骨化。由于腺病毒表达水平难以控制,过高表达Smad7可能完全阻断BMP2诱导的软骨化进程,无法观察过程中各因子变化。因此本研究采用在BMP2诱导下内源性高表达Smad7的间充质干细胞为模型,观察Smad7在软骨化全过程中的作用,分析Sox9对其在BMP2诱导成软骨过程中的影响与作用。
本研究结果显示,BMP2诱导MSCs第3、7、11天时,Smad7 mRNA明显升高,而Sox9与BMP2联合应用时,在7 d与11 d,Smad7表达较BMP2单用组明显降低,提示Sox9可能下调了BMP2诱导的Smad7 mRNA 表达;Sox9与BMP2联合处理11 d,Smad7蛋白水平明显低于BMP2组,显示Sox9有效抑制了BMP2诱导下的Smad7蛋白水平的表达。结合前期我们的研究:Sox9与BMP2联用可明显上调Col2al等软骨形成因子表达这一现象[7],可以认为Sox9可能通过抑制Smad7这一重要软骨负性因子,上调了BMP2下游的成软骨因子表达,增强了BMP2诱导软骨形成的能力。MMP13与OPN是软骨化过程中重要负性因子,其表达与Smad7密切相关。OPN是成骨重要标志因子,其表达升高提示软骨矿化进入软骨内成骨阶段[11];MMP13能起到分解Col2al的作用,是促进软骨基质降解,破坏软骨形态的重要因子[12, 13]。两者表达的升高提示软骨细胞最终成熟,丧失软骨表型而逐渐被矿化。有研究发现,Smad7敲除鼠生长板内软骨最终成熟受到抑制,使得软骨细胞维持稳定[6],该过程伴有MMP13与OPN因子在生长板内明显下调,提示Smad7表达与MMP13与OPN因子变化密切相关。我们前期研究发现Sox9可通过抑制成骨因子ALP与Runx2的表达,进而抑制软骨细胞肥大矿化[7]。为了进一步探讨Sox9对Smad7在软骨成熟方面的作用,我们关注了与Smad7密切相关的MMP13与OPN因子,发现感染11 d 时,高表达Sox9抑制Smad7表达的同时,也抑制了OPN和MMP13的表达,阻碍了软骨内骨化的进程。Wang等[12]也研究发现:BMP2可抑制MMP13表达,使MMP13维持在相对低的水平,加入Sox9可进一步增强BMP2抑制MMP13的作用。这些研究结果均提示:Sox9可能通过抑制Smad7及其成软骨负性相关因子的表达,阻断了软骨细胞最终成熟与矿化,维持了软骨形态。
综上所述,本研究初步探明了Sox9增强BMP2诱导成软骨的作用可能与其抑制了Smad7有关,即Sox9可抑制BMP2诱导下高表达的成软骨负性调控因子——Smad7的表达,从而进一步增强了BMP2成软骨的效应。Sox9在优化BMP2成软骨效应的同时,抑制软骨细胞的终末分化进程,保持了软骨细胞形态和基质的稳定。Smad7可能是Sox9发挥这些功效的作用靶点。然而由于Smad7作用的多样性与复杂性,不同表达水平的Smad7对BMP2诱导的软骨化是否起到不同作用尚待研究。Smad7在Sox9增强BMP2诱导的软骨化的详尽机制还有待进一步探索。
| [1] | Steinert A F, Noth U, Tuan R S. Concepts in gene therapy for cartilage repair[J]. Injury, 2008, 39(Suppl 1): S97-S113. |
| [2] | Steinert A F, Ghivizzani S C, Rethwilm A, et al. Major biological obstacles for persistent cell-based regeneration of articular cartilage[J]. Arthritis Res Ther, 2007, 9(3): 213. |
| [3] | Nishimura R, Hata K, Ono K, et al. Regulation of endochondral ossification by transcription factors[J]. Front Biosci (Landmark Ed), 2012, 17: 2657-2666. |
| [4] | Cao X, Chen D. The BMP signaling and in vivo bone formation[J]. Gene, 2005, 357(1): 1-8. |
| [5] | Tsumaki N, Yoshikawa H. The role of bone morphogenetic proteins in endochondral bone formation[J]. Cytokine Growth Factor Rev, 2005, 16(3): 279-285. |
| [6] | Estrada K D, Wang W, Retting K N, et al. Smad7 regulates terminal maturation of chondrocytes in the growth plate[J]. Dev Biol, 2013, 382(2): 375-384. |
| [7] | Liao J, Hu N, Zhou N, et al. Sox9 potentiates BMP2-induced chondrogenic differentiation and inhibits BMP2-induced osteogenic differentiation[J]. PLoS One, 2014, 9(2): e89025. |
| [8] | Nishimura R, Hata K, Matsubara T,et al. Regulation of bone and cartilage development by network between BMP signalling and transcription factors[J]. J Biochem, 2012, 151(3): 247-254. |
| [9] | Jain A, Kebaish K M, Sponseller P D. Factors associated with use of bone morphogenetic protein during pediatric spinal fusion surgery: an analysis of 4817 patients[J]. J Bone Joint Surg Am, 2013, 95(14): 1265-1270. |
| [10] | Iwai T, Murai J, Yoshikawa H, et al. Smad7 inhibits chondrocyte differentiation at multiple steps during endochondral bone formation and down-regulates p38 MAPK pathways[J]. J Biol Chem, 2008, 283(40): 27154-27164. |
| [11] | Mi M, Jin H, Wang B, et al. Chondrocyte BMP2 signaling plays an essential role in bone fracture healing[J]. Gene, 2013, 512(2): 211-218. |
| [12] | Wang M, Shen J, Jin H, et al. Recent progress in understanding molecular mechanisms of cartilage degeneration during osteoarthritis[J]. Ann N Y Acad Sci, 2011,1240: 61-69. |
| [13] | Johansson N Saarialho-Kere U, Airola K,et al. Collagenase-3 (MMP-13) is expressed by hypertrophic chondrocytes, periosteal cells, and osteoblasts during human fetal bone development[J]. Dev Dyn, 1997, 208(3): 387-397. |



