乳腺癌是女性最常见的恶性肿瘤,雌激素在乳腺癌的发生、发展中扮演着重要角色。经典雌激素信号通路主要由核雌激素受体(nuclear estrogen receptors,nERs)介导其基因转录效应,亦称基因组信号(genomic signaling)。近年有研究表明一种位于质膜且独立作用的膜性雌激素受体(G-protein coupled estrogen receptor,GPER),其作用方式与经典的nERs不同,主要通过介导雌激素作用活化其下游的快速非基因组信号通路(non-genomic signaling),包括MAPK/ERK、PI3K/AKT、cAMP、钙离子流动等发挥细胞生长、迁移、侵袭、血管形成等恶性生物学效应[1, 2, 3, 4]。诸多研究学者提出GPER可能是代表雌激素相关性肿瘤预后的有效指标之一。
炎症微环境是促进肿瘤进展的重要因素[5],其中IL-6所介导的下游信号转导和转录激活因子3(signal transducers and activators of transcription 3,STAT3)在诱导和维持肿瘤炎症微环境以及促进肿瘤发展与转移中起着重要作用。研究发现,子宫内膜癌患者血清中的IL-6水平与体内雌激素水平呈正相关,并且促进肿瘤增殖、生存、侵袭等[6],提示雌激素信号通路有可能调节IL-6表达。然而,在经典雌激素受体ERs阴性的乳腺癌中,GPER所介导的雌激素效应是否调控肿瘤中IL-6的表达及其下游信号的生物学行为仍不明确。本研究拟利用17-β雌二醇(E2)、GPER特异性激动剂(G1)[7]、GPER特异性拮抗剂(G15)[8]、STAT3特异性抑制剂(JSI-124)[9, 10]等小分子化合物探讨GPER对IL-6/STAT3炎症信号的调控及其在ERs阴性乳腺癌SKBR-3细胞生长中的作用。 1 材料与方法 1.1 材料
MCF-7、SKBR-3细胞系购自中国科学院上海细胞库,高糖1640培养基、高糖DMEM培养基、南美胎牛血清(Gibco公司),17-β雌二醇E2、GPER特异性激动剂G1、GPER特异性拮抗剂G15、IL-6中和抗体Anti-IL-6、STAT3特异性抑制剂JSI-124(Sigma公司),CCK-8 试剂盒及BCA蛋白浓度测定试剂盒(碧云天公司),IL-6 ELISA试剂盒(武汉博士德公司),GPER抗体(Abcam公司),p-STAT3抗体及STAT3抗体(CST公司),ERα与ERβ抗体(Bioworld Technology,Inc.),β-actin 抗体、山羊抗兔IgG抗体、山羊抗鼠IgG抗体(北京中杉金桥公司)。凝胶成像仪、SDS-PAGE蛋白电泳仪和蛋白转膜仪(上海天能公司),二氧化碳培养箱(Thermo scientific),多功能酶标仪(Sunrise)。 1.2 方法 1.2.1 细胞培养
SKBR-3与MCF-7细胞分别培养于10%胎牛血清的高糖DMEM和1640培养基中,37 ℃、5% CO2培养箱内生长,隔日换液,待细胞密度生长至90%左右时用0.25%胰酶消化离心后传代。 1.2.2 细胞免疫荧光
取对数期生长的SKBR-3细胞胰酶消化离心重悬后以2×105/mL接种于底部放有小玻片的24孔板中,置于细胞孵箱中培养,待细胞生长状态及密度合适后,取出24孔板用PBS洗3次,加入4%多聚甲醛200 μL固定20 min,PBS洗3次,10%山羊血清37 ℃封闭30 min,加入GPER抗体(1 ∶150稀释)40 μL,4℃孵育过夜,PBS洗3次,暗室中加入荧光二抗(1 ∶200),37 ℃ 60 min,PBS洗3次,加入DAPI(1 ∶10)染核5 min,PBS洗3次,每次5 min,封片后,倒置荧光显微镜下拍照。 1.2.3 ELISA法检测细胞上清中IL-6的分泌量
待培养瓶中细胞生长至80%~90%后,更换无血清培养基饥饿24 h。分别用E2、G1及G15处理SKBR-3细胞,其中含G15处理组提前加入G15预处理1 h,E2及G1处理时间为24 h,使E2、G1及G15的药物终浓度分别为100、100 nmol/L和1 μmol/L,各组调整DMSO至一致,最后分别得到对照组、E2处理组、G1处理组、E2+G15处理组、G1+G15处理组。收集细胞上清液,保存于-80 ℃冰箱,按ELISA试剂盒操作说明书检测样本。实验重复3次。 1.2.4 CCK-8检测
取对数生长期SKBR-3细胞胰酶消化离心重悬后以每100微升含10%胎牛血清的DMEM培养基中2 000个细胞浓度接种于96孔板中,每孔加入100 μL细胞悬液。待细胞贴壁后,加入相应药物处理,其中含G15处理组提前加入G15预处理1 h,最后每孔中E2、G1、G15、Anti-IL-6和JSI-124的药物终浓度分别为100 nmol/L、 100 nmol/L、1 μmol/L、0.5 μg/mL和10 μmol/L。背景组不种细胞只加入相应体积的培养基,每组设置5个复孔,各组调整DMSO的量至同一剂量,最后分别得到对照组、E2处理组、G1处理组、E2+G15处理组、G1+G15处理组、E2+Anti-IL-6处理组、G1+Anti-IL-6处理组、 E2+JSI-124处理组、G1+JSI-124处理组。培养24 h后,每孔加入10 μL CCK-8试剂,细胞孵箱中孵育2 h,波长选择450 nm,酶标仪测定各孔的光密度值[D(450)],计算各处理组中的相对细胞数。 1.2.5 Western blot检测
待培养瓶中细胞生长至70%~80%后,更换无血清培养基饥饿24 h后,加入100 nmol/L浓度的E2及G1在多个时间点(1、3、6、12 h)处理细胞以检测不同时间点E2与G1对SKBR-3细胞中p-STAT3蛋白表达的影响;加入E2、G1、G15、Anti-IL-6和JSI-124后检测上述不同药物处理后对SKBR-3细胞中p-STAT3蛋白表达的影响,其中E2及G1的处理时间分别为12 h和3 h,含G15处理组中提 前加入G15预处理1 h,最后使E2、G1、G15、Anti-IL-6 和JSI-124的药物终浓度分别为100 nmol/L、100 nmol/L、 1 μmol/L、0.5 μg/mL和10 μmol/L,各组调整DMSO至一致,最后分别得到对照组、E2处理组、G1处理组、E2+G15处理组、G1+G15处理组、E2+Anti-IL-6 处理组、G1+Anti-IL-6处理组、E2+JSI-124处理组、G1+JSI-124处理组。处理相应时间后立即终止药物处理,将细胞移入EP管中,以1 ∶100加入PMSF以及氟化钠至细胞裂解液中,冰上裂解30 min,离心后取上清蛋白溶液,用BCA试剂盒以及酶标仪测定蛋白浓度,经SDS-PAGE分离,半干法转移至PVDF膜,5%脱脂奶粉封闭液中室温封闭2 h,加入一抗 p-STAT3(1 ∶1 000)和STAT3(1 ∶1 000)4 ℃过夜,TBST洗膜3次,每次10 min,二抗(山羊抗兔,1 ∶1 000)置于37 ℃ 水浴箱中孵育1 h,TBST洗膜3次,化学发光成像,Quantity One软件进行灰度值测定。实验重复3次。 1.3 统计学分析
数据用x±s表示,采用SPSS 17.0统计软件,进行重复测量方差分析和独立样本t检验。 2 结果 2.1 ERs阴性乳腺癌细胞SKBR-3表达膜性雌激素受体GPER
细胞免疫荧光实验表明,SKBR-3细胞表达膜性雌激素受体GPER,其表达主要定位于细胞浆中(图 1)。Western blot检测结果显示,经典核雌激素受体ERs阳性的MCF-7乳腺癌细胞高表达ERα与ERβ,而在SKBR-3细胞中均未检测到其表达。此外,以上两种乳腺癌细胞株均有较高水平的GPER蛋白表达(图 2)。以上实验提示,乳腺癌SKBR-3细胞不表达传统核雌激素受体ERs而表达膜性雌激素受体GPER,为后续实验提供良好细胞膜性。
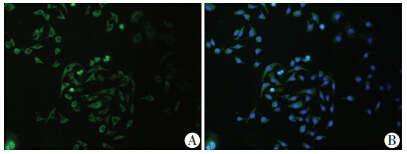 |
| A:GPER主要表达于细胞浆;B:目的荧光GPER与细胞核融合 图 1 细胞免疫荧光检测乳腺癌SKBR-3细胞中GPER的表达(荧光显微镜 ×200) |
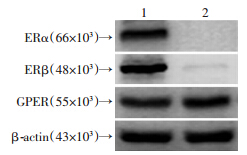 |
| 1:MCF-7细胞;2:SKBR-3细胞 图 2 Western blot检测乳腺癌MCF-7、SKBR-3细胞中各雌激素受体的表达 |
ELISA结果显示,药物处理24 h后,E2及G1显著促进SKBR-3细胞上清液中IL-6的分泌量,包含G15 的处理组可明显抑制IL-6的表达(P<0.05,图 3)。说明E2及G1通过活化GPER促进细胞中IL-6的表达。
 |
| 1:对照组;2:E2处理组;3:G1处理组;4:E2+G15处理组; 5:G1+G15处理组;a:P<0.05,与对照组比较;b:P<0.05,与E2+G15处理组比较;c:P<0.05,与G1+G15处理组比较 图 3 ELISA检测阻断GPER活性后E2及G1对SKBR-3 细胞中IL-6表达的影响 |
CCK-8检测结果提示,E2及G1处理24 h后显著促进细胞增殖能力,其相对细胞数分别为对照组的(1.68±0.13)倍与(1.74±0.21)倍,用GPER特异性拮抗剂G15和IL-6中和抗体(Anti-IL-6)分别拮抗GPER和IL-6后,细胞增殖活性明显降低(P<0.05,图 4)。这说明GPER/IL-6通路介导雌激素对细胞的增殖作用。
 |
| 1:对照组;2:E2处理组;3:G1处理组;4:E2+G15处理组;5:G1+G15处理组;6:E2+Anti-IL-6处理组;7:G1+Anti- IL-6处理组;a:P<0.05,与对照组比较;b:P<0.05,与E2+ G15处理组比较;c:P<0.05,与E2+Anti-IL-6处理组比 较;d:P<0.05,与G1+G15处理组比较; e:P<0.05,与G1+ Anti-IL-6处理组比较 图 4 CCK-8检测不同药物处理后对SKBR-3细胞增殖活性的影响 |
我们进一步用Western blot检测E2及G1处理细胞后不同时间点的STAT3信号活化情况,结果显示,E2及G1可显著促进细胞中磷酸化STAT3的蛋白表达(P<0.05,图 5),且呈现时间依赖性,两者表达的峰值分别位于12 h和3 h,其蛋白相对表达量分别为对照组的(2.54±0.23)倍和(3.12±0.24)倍。
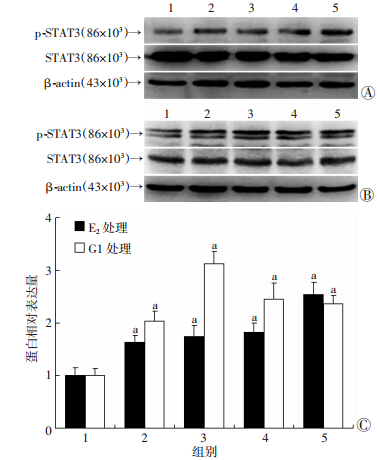 |
| 1:对照组;2:1 h处理组;3:3 h处理组;4:6 h处理组;5:12 h 处理组A:100 nmol/L E2处理;B:100 nmol/L G1处理;C:蛋白相对表达量 a:P<0.05,与对照组比较 图 5 Western blot检测不同时间点E2与G1对SKBR-3 细胞中p-STAT3蛋白表达的影响 |
分别在最佳时间点处理细胞后,Western blot检测结果显示,G15、Anti-IL-6与STAT3特异性抑制剂JSI-124可显著抑制E2及G1诱导的p-STAT3蛋白表达(P<0.05,图 6)。这提示E2与G1可显著活化SKBR-3细胞中GPER/IL-6/STAT3信号通路。
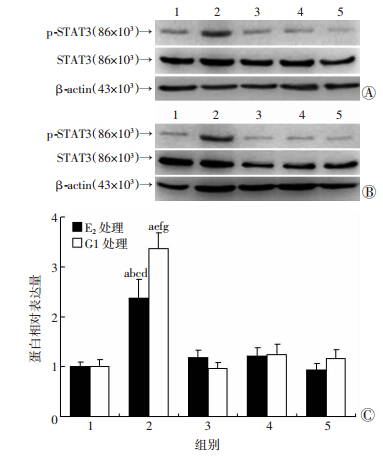 |
| 1:对照组;2:E2/G1处理组;3:E2/G1+G15处理组;4:E2/G1+ Anti-IL-6处理组;5:E2/G1+JSI-124处理组 A:100 nmol/L E2处理;B:100 nmol/L G1处理;C:蛋白相对表达量 a:P< 0.05,与对照组比较;b:P<0.05,与E2+G15处理组比较;c:P<0.05,与E2+Anti-IL-6处理组比较;d:P<0.05,与E2+JSI-124处理组比较;e:P<0.05,与G1+G15处理组比较;f:P<0.05,与G1+Anti-IL-6处理组比较;g:P<0.05,与G1+JSI-124处理组比较 图 6 Western blot检测不同药物处理后对SKBR-3细胞中 p-STAT3蛋白表达的影响 |
与Western blot检测结果类似,分别用G15、Anti-IL-6与JSI-124处理细胞后,均可显著阻断E2及G1对细胞的促增殖作用(P<0.05,图 7)。这说明雌激素可通过活化ER(-)乳腺癌SKBR-3细胞中的膜性受体GPER自分泌IL-6,从而激活其下游的IL-6/STAT3炎症信号通路,最终促进细胞的增殖能力。
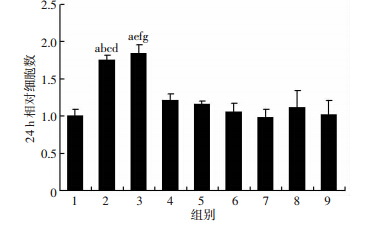 |
| 1:对照组;2:E2处理组;3:G1处理组;4:E2+G15处理组;5:G1+G15处理组;6:E2+Anti-IL-6处理组;7:G1+Anti-IL-6处理组;8:E2+JSI-124处理组;9:G1+JSI-124处理组 a:P<0.05,与对照组比较;b:P<0.05,与E2+G15处理组比较;c:P<0.05,与E2+Anti-IL-6处理组比较;d:P<0.05,与E2+JSI-124处理组比较;e:P<0.05,与G1+G15处理组比较;f:P<0.05,与G1+Anti-IL-6处理组比较;g:P<0.05,与G1+JSI-124处理组比较 图 7 GPER/IL-6/STAT3信号通路的活化对SKBR-3细胞 增殖能力的影响 |
炎症微环境与肿瘤的进展密切相关,IL-6是目前被发现的功能最广泛的炎性细胞因子之一,它在肿瘤患者血清中的高表达与不良预后具有显著相关性。它还与诸多雌激素相关性肿瘤的生长、侵袭等恶性行为紧密联系,包括乳腺癌[11]、卵巢癌[12]、子宫内膜癌[5]等。有学者发现,乳腺癌患者血清中的IL-6水平与体内雌激素水平呈正相关,提示雌激素信号通路可能调控IL-6的表达[13]。Binai等[14]研究发现雌激素能激活STAT3信号,进一步提示雌激素信号与IL-6、STAT3三者之间可能存在某种调控网络。
本研究发现,在ERs阴性的乳腺癌SKBR-3细胞中,E2及G1可通过活化膜性雌激素受体GPER上调细胞上清液中IL-6的分泌量,而自分泌的IL-6又可激活细胞中下游STAT3信号通路,促进磷酸化STAT3蛋白的表达。用G15、Anti-IL-6和JSI-124处理细胞后进一步证明GPER介导的IL-6/STAT3炎症信号通路活化可促进SKBR-3细胞增殖,提示由GPER所介导的雌激素信号对炎症微环境的激活作用可能在ER阴性乳腺癌患者的不良进展中扮演重要角色。
研究发现,雌激素可活化GPER促进子宫内膜癌细胞中IL-6的表达,并且其机制可能与细胞中GPER/ERK信号通路的激活有关[6]。本实验也得到类似结果,用GPER特异性拮抗剂G15处理细胞后,E2及G1所刺激的IL-6分泌量被显著抑制,提示GPER的活化参与IL-6表达的调控。然而,在SKBR-3细胞中,GPER信号调节IL-6表达的具体机制仍然需要进一步探讨阐明。本研究进一步发现有趣的信号通路激活模式,SKBR-3细胞自分泌的IL-6可以作用于自身激活其下游的STAT3信号通路,促进p-STAT3蛋白的表达,用G15、IL-6中和抗体Anti-IL-6及STAT3特异性抑制剂JSI-124处理细胞后,p-STAT3蛋白表达被明显阻断,提示雌激素作用下GPER可特异性介导IL-6/STAT3炎症信号通路的活化。Jiang等[15]研究结果与本研究相似,他们用雌激素作用ER阴性乳腺癌细胞后发现细胞上清液中IL-8的水平升高,并且通过细胞自身的IL-8受体CXCR1促进细胞迁移及侵袭。由此可见,由GPER所介导的炎症微环境可激活自身细胞中某些炎症信号的异常活化。
由GPER所介导的乳腺癌细胞增殖效应已被大量研究[2, 3, 4, 16]证实,雌激素与GPER结合后,通过转活表皮生长因子受体EGFR信号激活其下游的MAPK/ERK或PI3K/AKT通路从而达到促进细胞增殖目的。在本实验中,我们将GPER所介导的促细胞增殖的机制更加细化,提出其可能是通过活化GPER信号下游的IL-6/STAT3通路来达到促进肿瘤生长的作用。因 此,雌激素活化下的GPER/ERK/IL-6/STAT3或GPER/ AKT/IL-6/STAT3通路可能是抑制ER阴性肿瘤异常增殖的新靶点。
综上所述,雌激素可通过活化GPER促进ER阴性乳腺癌SKBR-3细胞中IL-6的表达水平,进而激活自身细胞中IL-6/STAT3炎症信号通路发挥细胞增殖的效应,提示由GPER介导的炎症微环境可能是对抗肿瘤进展的新型靶向模式,为目前的治疗模式拓宽思路。但是这还需要更多的体内及体外实验与前瞻性研究来进一步验证和支持。
| [1] | De-Francesco E M, Lappano R, Santolla M F, et al. HIF-1α/GPER signaling mediates the expression of VEGF induced by hypoxia in breast cancer associated fibroblasts (CAFs)[J]. Breast Cancer Res, 2013, 15(4): R64. |
| [2] | Yu T, Liu M, Luo H, et al. GPER mediates enhanced cell viability and motility via non-genomic signaling induced by 17β-estradiol in triple-negative breast cancer cells[J]. J Steroid Biochem Mol Biol, 2014, 143: 392-403. |
| [3] | Mo Z, Liu M, Yang F, et al. GPR30 as an initiator of tamoxifen resistance in hormone-dependent breast cancer[J]. Breast Cancer Res, 2013, 15(6): R114. |
| [4] | Luo H, Yang G, Yu T, et al. GPER-mediated proliferation and estradiol production in breast cancer-associated fibroblasts[J]. Endocr Relat Cancer, 2014, 21(2): 355-369. |
| [5] | Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. |
| [6] | He Y Y, Cai B, Yang Y X, et al. Estrogenic G protein-coupled receptor 30 signaling is involved in regulation of endometrial carcinoma by promoting proliferation, invasion potential, and interleukin-6 secretion via the MEK/ERK mitogen-activated protein kinase pathway[J]. Cancer Sci, 2009, 100(6): 1051-1061. |
| [7] | Bologa C G, Revankar C M, Young S M, et al. Virtual and biomolecular screening converge on a selective agonist for GPR30[J]. Nat Chem Biol, 2006, 2(4): 207-212. |
| [8] | Dennis M K, Burai R, Ramesh C, et al. In vivo effects of a GPR30 antagonist[J]. Nat Chem Biol, 2009, 5(6): 421-427. |
| [9] | Blaskovich M A, Sun J, Cantor A, et al. Discovery of JSI-124 (cucurbitacin I), a selective Janus kinase/signal transducer and activator of transcription 3 signaling pathway inhibitor with potent antitumor activity against human and murine cancer cells in mice[J]. Cancer Res, 2003, 63(6): 1270-1279. |
| [10] | Luo F, Xu Y, Ling M, et al. Arsenite evokes IL-6 secretion, autocrine regulation of STAT3 signaling, and miR-21 expression, processes involved in the EMT and malignant transformation of human bronchial epithelial cells[J]. Toxicol Appl Pharmacol, 2013, 273(1): 27-34. |
| [11] | Choi Y K, Cho S G, Woo S M, et al. Herbal extract SH003 suppresses tumor growth and metastasis of MDA-MB-231 breast cancer cells by inhibiting STAT3-IL-6 signaling[J]. Mediators Inflamm, 2014, 2014: 492173. |
| [12] | Kumar J, Ward A C. Role of the interleukin 6 receptor family in epithelial ovarian cancer and its clinical implications[J]. Biochim Biophys Acta, 2014, 1845(2): 117-125. |
| [13] | Cho Y A, Sung M K, Yeon J Y, et al. Prognostic role of interleukin-6, interleukin-8, and leptin levels according to breast cancer subtype[J]. Cancer Res Treat, 2013, 45(3): 210-219. |
| [14] | Binai N A, Damert A, Carra G, et al. Expression of estrogen receptor alpha increases leptin-induced STAT3 activity in breast cancer cells[J]. Int J Cancer, 2010, 127(1): 55-66. |
| [15] | Jiang Q F, Wu T T, Yang J Y, et al. 17β-estradiol promotes the invasion and migration of nuclear estrogen receptor-negative breast cancer cells through cross-talk between GPER1 and CXCR1[J]. J Steroid Biochem Mol Biol, 2013, 138: 314-324. |
| [16] | 余腾骅, 罗浩军, 严玉钊, 等. GPR30介导雌激素对三阴性乳腺癌MDA-MB-468细胞系增殖的影响[J]. 第三军医大学学报, 2014, 36(14): 1467-1471. |



