线粒体DNA(mitochondrial DNA,mtDNA)突变是导致母系遗传药物性耳聋最重要的原因之一,同时也是导致携带此突变的个体对氨基糖甙类抗生素(aminoglycoside antibiotics,AmAn)高度易感而使听觉细胞功能障碍继而产生耳聋的主要因素[1]。精确的线粒体缺失导致组织特异性耳聋的病理机制目前仍不清楚。早期采用家系连锁分析方法和淋巴细胞系研究,定位了TRMU、MTO1、TFB1M、GTPBp3 4个核基因和线粒体RNA修饰、线粒体耳聋有关[2, 3, 4, 5, 6]。2009年Cotney等[7]研究发现最常见的导致遗传性线粒体耳聋的A1555G突变同线粒体转录因子(mitochondrial transcription factor B1,TFB1M)过表达相似,TFB1M的过表达引出依赖于rRNA超甲基化的逆向信号,导致异常的线粒体合成,诱导易感细胞,增加细胞死亡。因此我们选择TFB1M作为遗传性药物性耳聋的研究点,试图研究TFB1M的表达和药物性耳聋的关系。由于无法取得药物性耳聋患者的耳蜗组织,因此我们选择动物作为研究对象。哺乳动物听觉系统由毛细胞和支持细胞所组成,毛细胞、听觉神经和听觉中枢一起维持正常的听力。一旦毛细胞损伤,会出现不可逆的感音神经性耳聋。氨基糖甙类抗生素在毛细胞中的主要积聚部位是线粒体和溶酶体;在离体和全身用药的情况下,哺乳类耳蜗毛细胞同样保持对氨基糖甙类药物的特殊敏感性,因此我们设想用耳毒性药物新霉素致损ICR小鼠,对该模型下ICR小鼠耳蜗听觉上皮TFB1M的表达与线粒体、毛细胞的关系进行研究,以期为线粒体突变所致药物性耳聋的治疗和预防提供参考。 1 材料与方法 1.1 实验动物与试剂
由中国科学院实验动物中心提供出生1~2 d的ICR小鼠20只(雌雄不限),体质量1~2 g。
新霉素、Poly-L-lysine、 DAPI、TMRM(美国Sigma公司),Bovine Plasma Frbronectin、HBSS、FBS、SuperscriptⅢ firststrand、PI(美国Invitrogen公司),DMEM/F12、N2、B27(美国Gibco公司),Myosin7a 抗体(加拿大Proteus Biosciences公司),曲通-X100(上海华美生物工程公司),phalloidin抗体(美国MolecuLar Probes公司),RNeasy Mini Kit(德国Qiagen公司),无水乙醇、氯仿、异丙醇(国药集团化学试剂有限公司),SYBGreen PCR Mix(Bio-Rad公司),JC-I、线粒体蛋白质提取试剂盒(碧云天公司),TFB1M抗体(Metodi D. Metodiev教授赠送,德国),TBE buffer RT205(天根公司),PCR buffer DR100、dNTP MIX DR100、Taq聚合酶 DR100(TaKaRa公司),引物由上海生工公司合成。 1.2 实验方法 1.2.1 耳蜗上皮的分离培养及鉴定
将出生24 h的新生ICR小鼠断头处死后,于培养室无菌环境中在解剖显微镜下暴露听泡,用游丝镊分离听泡周围组织后,完全暴露耳蜗,在HBSS中去除耳蜗骨性部分,用游丝镊取出耳蜗听觉上皮,移入涂布多聚赖氨酸的培养皿中,铺平听觉上皮后,尽量吸尽组织周围的培养液,放置冰上30 min后,然后加入含10%FBS的培养基40 μL,放入37 ℃ CO2培养箱2 h,最后加入无血清培养液1 500 μL,放入37 ℃ CO2培养箱培养,隔天按半量更换培养液。鉴定步骤:培养后高倍镜下可见听觉上皮贴壁好,轮廓清晰,可见耳蜗内、外毛细胞及支持细胞。终止实验后,取出耳蜗用 PBS清洗3遍,再用40 g/L多聚甲醛固定,4 ℃冰箱过夜,待染色用。常规用Phalloidin染色后,普通显微镜下或激光共聚焦显微镜下观察可见3~4排外毛细胞,1排内毛细胞,支持细胞[8]39-41。 1.2.2 实验分组及处置
每次选取20只出生1~2 d的ICR小鼠共40个耳蜗(听觉上皮),40个听觉上皮在CO2培养箱过夜培养24 h后,随机加入新霉素(1 mmol/L)作用的20个耳蜗标为新霉素致损组,同时未加入新霉素的另20只培养的耳蜗为正常对照组。新霉素致损组观察的4个时间点为在新霉素作用4、12、24 h及24 h洗脱后2 d,致损的20只听觉上皮无血清清洗2次洗去新霉素,然后取出用PBS清洗3遍,收集标本提取RNA或蛋白质,或PBS清洗后再用40 g/L 多聚甲醛固定,4 ℃ 冰箱过夜,待染色用;正常对照组在和新霉素致损组相对应的时间点收集耳蜗标本。然后依照相同实验方法每次另取ICR小鼠20只重复实验,且所有实验重复3次。 1.2.3 免疫荧光染色
上述固定后过夜标本,用0.1 g/L PBS清洗3次,0.3% Triton 37 ℃ 孵育30 min,再以FITC-Phalloidin 1 ∶400 37 ℃ 孵育30 min,PBS 清洗3次,1 ∶1 000 DAPI 室温作用10 min,PBS 清洗3次;甘油封片,荧光显微镜下进行观察。 1.2.4 基因和蛋白表达检测 1.2.4.1 TFB1M、TFB2M、Caspase-3、Caspase-7、Caspase-8、Caspase-9、XIAP的mRNA水平表达检测
采用RNeasy Mini Kit法提取各组样本总RNA,并行浓度和纯度的测定及电泳鉴定。获取反转录产物cDNA,使用SYBGreen PCR Mix试剂盒对获取的反转录产物行实时PCR。 1.2.4.2 TFB1M的蛋白表达水平检测
收集培养的基底膜,提取线粒体、细胞质蛋白、核蛋白及线粒体蛋白,行Western blot定量分析,压片、显影后胶片用扫描仪扫描,显色条带用Image J软件测定灰度,用目标蛋白TFB1M与HSP60蛋白条带的比值来表示目标蛋白的表达量。 1.2.5 线粒体膜电位检测
以JC-1商业试剂盒检测各组标本的线粒体膜电位变化情况。 1.3 统计学方法
采用SPSS 20.0统计软件,行总体方差分析,先行方差齐性检验,提示方差齐后进行方差分析;4个时间点采用Tukey多重比较。 2 结果 2.1 耳蜗上皮培养及鉴定
听觉上皮生长良好,在荧光显微镜下,经Phalloidin染色后,可见居内圈的1排耳蜗内毛细胞和外圈的3~4排外毛细胞(图 1)。
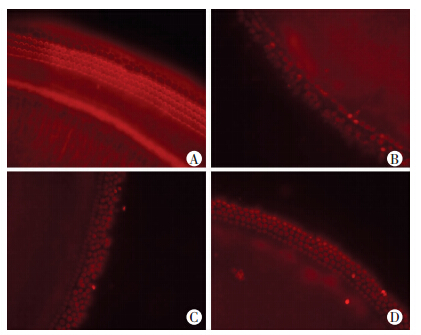 |
| A:正常听觉上皮;B:新霉素致损12 h听觉上皮底圈;C:新霉素致损12 h听觉上皮中圈;D:新霉素致损12 h听觉上皮顶圈 图 1 新霉素致损新生ICR小鼠耳蜗后听觉上皮免疫 荧光观察结果(荧光显微镜 ×40) |
正常JC-1阳性对照:毛细胞线粒体膜电位完全丧失时,听觉上皮的毛细胞为绿色(图 2)。新霉素致损4 h,小鼠听觉上皮(基底膜)顶圈毛细胞完整,中圈4排毛细胞可,排列稍差,有散在的外毛细胞的线粒体膜电位降低,绿色荧光增强;底圈内毛细胞连续,外毛细胞可见部分缺失,缺失处未检测到膜电位。新霉素致损12 h,顶圈毛细胞完整,荧光强度较正常对照组降低;中圈4排毛细胞排列稍紊乱,毛细胞开始部分缺失,缺失处未检测到膜电位,残存毛细胞线粒体膜电位降低,绿色荧光增强;底圈内毛细胞欠连续,外毛细胞大量消失,无线粒体膜电位,残存毛细胞膜电位降低,绿色荧光增强(图 1)。而新霉素致损24 h后,小鼠听觉上皮顶圈见排列稍紊乱的毛细胞,线粒体膜电位还存在,但膜电位降低,绿色荧光增强。中圈毛细胞丢失严重,仅见散在少许毛细胞残存,未检测到线粒体膜电位,底圈毛细胞基本消失,未检测到线粒体膜电位,反之正常对照组培养的听觉上皮毛细胞排列整齐。
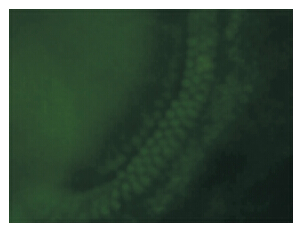 |
| 图 2 JC-I检测下线粒体膜电位改变(×40) |
RT-PCR检测结果显示,新霉素致损组凋亡基因Caspase-7、Caspase-9表达上调,凋亡保护基因XIAP下调。实时PCR检测结果显示,各基因mRNA水平的表 达中,新霉素致损组中TFB1M的表达是对照组的163%,Caspase-7的表达 是对照组的161%、Caspase-9的表达 是对照组的131%,Caspase-8的表达是对照组的156%,TFB2M的表达是对照组的59.6%,Caspase-3的表达是对照组33.8%,XIAP的表达是对照组的42.7%。 2.4 TFB1M蛋白水平的表达
新霉素致损12 h,TFB1M在耳蜗听觉上皮的线粒体和细胞核的表达较正常对照组的表达明显上调。新霉素致损4、12、24 h相对于对照组的改变量均有统计学差异(P<0.01),12 h较4、24 h,洗脱后2 d都明显(P<0.01,图 3、4)。
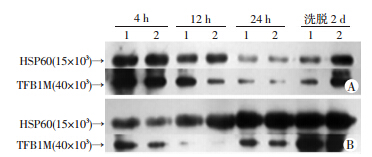 |
| A:线粒体内;B:细胞核内 1:新霉素致损组;2:正常对照组 图 3 Western blot检测ICR小鼠不同致损时间点听觉上皮 TFB1M蛋白表达 |
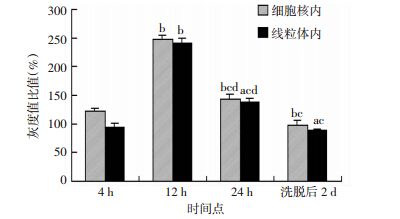 |
| a:P<0.05,b:P<0.01,与4 h比较;c:P<0.01,与12 h比较;d:P<0.01,与洗脱后2 d 比较 图 4 定量分析新霉素致损ICR小鼠听觉上皮不同时间点TFB1M蛋白的表达(n=20) |
TFB1M和线粒体耳聋综合征的潜在关系被注意是因为在KsgA缺乏的大肠杆菌株表达h-mtTFB1后可以恢复16S茎环的甲基化和对氨基糖甙类药物(春雷霉素)的敏感性[3]。KsgA是h-mtTFB1的细菌同源物,可以特异性的甲基化细菌16S rRNA 3′末端茎环的2个毗邻的腺嘌呤残基[9],TFBM有两个亚型:TFB1M和TFB2M。TFB1M和TFB2M由核基因编码后由细胞核转运至线粒体中[10, 11]。人类线粒体12S rRNA和细菌16S rRNA茎环3′末端(甲基化位点)是高度保守的,因此h-mtTFB1和h-mtTFB2可以替代大肠杆菌株的KsgA,甲基化细菌的16S rRNA 3′末端的茎环,从而恢复对春雷霉素的敏感性[3, 9]。Cotney等[7]在人类的HeLa细胞系中过表达TFB1M后增加了HeLa细胞对春雷霉素的敏感性。在高浓度春雷霉素作用下,过表达TFB1M导致有活力的HeLa细胞明显减少。那耳蜗毛细胞过表达TFB1M是否也同HeLa细胞系可增加毛细胞对春雷霉素的敏感性;在高浓度春雷霉素作用下,过表达TFB1M是否会导致有活力的毛细胞明显减少?鼠是最好的研究哺乳动物内耳的模型,因此我们试图研究在氨基糖甙类药物新霉素作用下,小鼠耳蜗听觉上皮TFB1M的表达和毛细胞的关系。如果确认有关,可以进一步研究TFB1M过表达是否导致小鼠听觉上皮对氨基糖甙类药物易感,从而导致12S rRNA超甲基化,影响线粒体功能,诱导耳蜗毛细胞凋亡,而减少TFB1M的表达或其活性是否会使12S rRNA甲基化水平恢复到正常,从而降低对氨基糖甙类药物的易感性,对毛细胞、耳蜗提供保护作用?这些研究结果可能会对线粒体药物性耳聋治疗和预防提供重要的参考。
为了观察核修饰基因TFB1M和小鼠听觉上皮线粒体、毛细胞的关系,我们首先检测了TFB1M基因在耳蜗听觉上皮的线粒体和细胞核内的表达。氨基糖甙类药物在内耳淋巴液中达到峰值浓度一般需要2~5 h,新霉素半衰期长达30 h[8]206,因此本实验检测了新霉素作用4、12、24 h,洗脱后2d 4个时间点的TFB1M蛋白质水平的表达,发现在新霉素致损4 h时,新霉素致损组耳蜗的听觉上皮细胞核和线粒体内TFB1M蛋白质水平的表达开始较正常对照组增加,致损12 h后表达明显上调,然后逐渐降低,新霉素致损24 h,洗脱后2 d,新霉素致损组耳蜗的听觉上皮细胞核和线粒体内TFB1M蛋白质水平的表达较正常对照组降低。结果提示新霉素致损4、12、24 h相对于对照组的改变量均有统计学差异,12 h较4、24 h,洗脱后2 d 都明显。
然后我们观察新霉素诱导致损下线粒体功能和毛细胞的关系。以往研究发现,通常耳蜗听觉上皮受损最早在底圈外毛细胞发现,耳蜗底圈的外毛细胞可能因较多线粒体最易受损,因此高频听力较低频更容易受损[12]。目前研究表明,线粒体膜电位可以作为线粒体通透性孔开放的标志,其在凋亡信号的刺激下将降低。这是凋亡级联反应过程中最先发生的重要事件之一,是细胞凋亡早期的一个标志性事件,也是线粒体功能紊乱的早期标志。线粒体功能正常时,线粒体膜电位是高的,JC-1以红色荧光为主。线粒体受损伤时,线粒体膜电位降低,JC-1不聚集在线粒体基质,此时红色荧光强度减少,绿色荧光强度增加。因此我们用JC-1检测听觉上皮的线粒体膜电位。我们先检测新霉素致损下线粒体膜电位的动态变化,发现新霉素致损4 h后,听觉上皮中圈毛细胞形态完整,但是线粒体膜电位已降低,而新霉素致损4 h洗脱后3 h,线粒体底圈、中圈线粒体膜电位消失,底圈、中圈出现散在死亡的毛细胞,正常对照组毛细胞线粒体完整,膜电位没有改变。本研究新霉素致损的听觉上皮免疫荧光染色结果显示,线粒体的膜电位的改变早于毛细胞形态的改变。Dehne等[13]在成年豚鼠毛细胞研究中,发现庆大霉素诱导致损4 h洗脱后1 h毛细胞线粒体膜电位丧失,线粒体膜电位丧失后1 h出现死亡的毛细胞。本研究结果和Dehne等[13]的实验结果相似,即线粒体功能紊乱在早期发生,毛细胞的线粒体膜电位的改变早于毛细胞形态改变、毛细胞凋亡和细胞死亡。
随后我们检测了新霉素致损组和正常对照组在相应致损时间点上耳蜗听觉上皮的改变即耳蜗毛细胞的形态以及线粒体膜电位。我们发现0.1 mmol/L新霉素诱导致损4 h,听觉上皮底圈部分毛细胞缺失,缺失处未检测到线粒体膜电位,残存的大部分毛细胞线粒体膜电位明显降低,同时中圈毛细胞排列整齐,但散在毛线粒体细胞膜电位已经降低,顶圈毛细胞完整;新霉素致损12 h,可见底圈毛细胞大量消失,无膜电位,残存毛细胞线粒体膜电位降低,中圈外毛细胞有缺失,缺失毛细胞处无线粒体膜电位,残存毛细胞线粒体膜电位明显降低,顶圈毛细胞尚完整,线粒体膜电位存在。新霉素致损24 h,基底膜顶圈的毛细胞排列尚整齐,线粒体膜电位还存在,但膜电位稍微有所降低,因为毛细胞对氨基糖甙类的吸收和毛细胞的成熟度有关,由于顶圈的毛细胞发育欠成熟,可能对氨基糖甙类药物产生耐药性,因此新霉素致损24 h还可以看见顶圈毛细胞的存在[14],听觉上皮底圈、中圈毛细胞基本上全部丢失,无法检测到线粒体膜电位。新霉素致损24 h洗脱后2 d,毛细胞未见进一步缺失。而正常对照组培养的听觉上皮在各对应时间点的毛细胞排列整齐。
氨基糖甙类抗生素在耳蜗引起的凋亡途径主要是内源性凋亡途径即线粒体细胞色素C的释放和Caspase-9激活,在氨基糖甙类药物引起的细胞死亡过程中起关键性作用。我们检测了与线粒体凋亡途径最常见基因Caspase-9、Caspase-3、Caspase-8、Caspase-7和抗凋亡基因XIAP的变化,结果显示新霉素致损组Caspase-7的表达是对照组的161%、Caspase-9的表达是对照组131%,Caspase-8表达是对照组的131%,Caspase-3和凋亡保护基因XIAP表达减少。
在以往的动物研究中发现,通常耳蜗受损最早在底圈外毛细胞发现,然后出现在耳蜗顶圈、内毛细胞。听觉上皮毛细胞从底圈到中圈逐渐缺失意味着会出现高频到中频的感音神经性耳聋。既往实验几乎无人涉及TFB1M和毛细胞的关系。而本研究表明,随着新霉素致损时间逐渐增加,TFB1M表达逐渐上调,相对应的听觉上皮的毛细胞出现从底圈到中圈逐渐缺失,线粒体膜电位改变;TFB1M表达逐渐降低后,毛细胞的缺失逐渐静止。同时在新霉素致损12 h TFB1M表达高时,出现凋亡相关基因Caspase-7、Caspase-8、Caspase-9表达上调。而正常对照组在新霉素致损相对应的时间点上,离体培养的听觉上皮的毛细胞形态完整,排列整齐,线粒体膜电位无改变。由于TFB1M的表达上调和毛细胞从底圈到中圈的逐渐缺失、线粒体膜电位改变、凋亡相关基因表达上调同时出现,因此我们认为TFB1M的表达和线粒体功能紊乱、耳蜗毛细胞的死亡、耳聋存在一定的关系。
据上所述,我们认为TFB1M蛋白质水平的表达上调可能导致听觉上皮线粒体功能异常和毛细胞凋亡,进而导致耳聋的产生,但是其确切的通路有待深入研究。
| [1] | 张祺, 张婷, 方如平, 等. 母系遗传药物性耳聋核基因TFB1M研究进展[J]. 中华耳科学杂志, 2011, 9(3): 353-355. |
| [2] | Bykhovskaya Y, Mengesha E, Wang D, et al. Human mitochondrial transcription factor B1 as a modifier gene for hearing loss associated with the mitochondrial A1555G mutation [J]. Mol Genet Metab, 2004, 82(1): 27-32. |
| [3] | Bykhovskaya Y, Mengesha E, Wang D, et al. Phenotype of non-syndromic deafness associated with the mitochondrial A1555G mutation is modulated by mitochondrial RNA modifying enzymes MTO1 and GTPBP3[J]. Mol Genet Metab, 2004, 83(3): 199-206. |
| [4] | Yan Q, Bykhovskaya Y, Li R, et al. Human TRMU encoding the mitochondrial 5-methylaminomethyl-2-thiouridylate-methyltransferase is a putative nuclear modifier gene for the phenotypic expression of the deafness-associated 12S rRNA mutations[J]. Biochem Biophys Res Commun, 2006, 342(4): 1130-1136. |
| [5] | Guan M X, Yan Q, Li X, et al. Mutation in TRMU related to transfer RNA modification modulates the phenotypic expression of the deafness-associated mitochondrial 12S ribosomal RNA mutations [J]. Am J Hum Genet, 2006, 79(2): 291-302. |
| [6] | Luo L F, Hou C C, Yang W X. Nuclear factors: roles related to mitochondrial deafness [J]. Gene, 2013, 520 (2): 79-89. |
| [7] | Cotney J, McKay S E, Shadel G S. Elucidation of separate, but collaborative functions of the rRNA methyltransferase-related human mitochondrial transcription factors B1 and B2 in mitochondrial biogenesis reveals new insight into maternally inherited deafness[J]. Hum Mol Genet, 2009, 18(14): 2670-2682. |
| [8] | 丁大连, 蒋涛, 亓卫东, 等. 内耳科学[M]. 北京: 中国科学技术出版社, 2010. |
| [9] | Guja K E, Venkataraman K, Yakubovskaya E, et al. Structural basis for S-adenosylmethionine binding and methyltransferase activity by mitochondrial transcription factor B1[J]. Nucleic Acids Res, 2013, 41(16): 7947-7959. |
| [10] | Sharoyko V V, Abels M, Sun J, et al. Loss of TFB1M results in mitochondrial dysfunction that leads to impaired insulin secretion and diabetes [J]. Hum Mol Genet, 2014, 23(21): 5733-5749. |
| [11] | Metodiev M D, Lesko N, Park C B, et al. Methylation of 12S rRNA is necessary for in vivo stability of the small subunit of the mammalian mitochondrial ribosome [J]. Cell Metab, 2009, 9(4): 386-397. |
| [12] | Selimoglu E. Aminoglycoside-induced ototoxicity[J]. Curr Pharm Des, 2007, 13(1): 119-126. |
| [13] | Dehne N, Raueu U, de-Groot H,et al. Involvement of the mitochondrial permeability transition in gentamicin ototoxicity[J]. Hear Res, 2002, 169(1/2): 47-55. |
| [14] | Romand R, Chardin S. Effects of growth factors on the hair cells after ototoxic treatment of the neonatal mammalian cochlea in vitro[J]. Brain Res, 1999, 825(1/2): 46-58. |



