肝癌(hepatocellular carcinoma,HCC)发病率居世界恶性肿瘤第5位,几乎45%的HCC病例出现于中国,且与乙型和丙型肝炎病毒感染有关[1]。HCC诊断时多数已属进展期,手术切除率低于50%,即使手术切除也易复发和转移,5年生存率只有10%~30%[2]。研究发现肝癌干细胞(liver cancer stem cells,LCSCs)具有自我更新、多潜能分化和对放化疗抵抗特性,可能是肝癌复发和转移的根源[3]。CD133、CD44、CD90、EpCAM、CD13和SP侧群单独作为LCSCs标志仍存在争议,文献[3, 4]发现只有CD13+CD133+LCSCs和CD133+ EpCAM+LCSCs最具有LCSCs生物学特征。研究发现三氧化二砷(arsenic trioxide,As2O3)明显抑制HCC细胞增殖、诱导癌细胞凋亡[5],但As2O3对HepG2和SMCC-7721的生长抑制机制仍不清楚。为了解HepG2、Hep3B、HuH7和SMCC-7721细胞是否含LCSCs,低浓度砷剂是否抑制LCSCs Oct4、Sox2的表达,明确低浓度砷剂对LCSCs分化有无作用,本研究观察HepG2、Hep3B、HuH7、SMCC-7721和原代HCC细胞CD133、CD13标志表达及其对亚砷酸钠反应的差异,分析低浓度亚砷酸钠对HuH7和原代HCC细胞Oct4、Sox2因子表达的调节作用。 1 材料与方法 1.1 材料
人肝癌HuH7细胞由第三军医大学西南医院病理研究所提供,HepG2、Hep3B和SMCC-7721由西南医院肝胆外科研究所赠送。CD13荧光抗体购自BD公司,CD133荧光抗体购自美天尼公司,CCK-8、DMEM培养基和胎牛血清为HyClone产品,Oct4抗体购自Abcom公司,Sox2为Cell Signaling Technology公司产品。流式细胞仪为BD FACSAria Ⅱ,使用Thermo Multiskan Spectrum全波长酶标仪。激光共聚焦显微镜为LSM780。总RNA提取试剂盒、cDNA逆转录试剂盒为BioFlux产品。Promega GoTaq qPCR Master Mix为Promega公司产品。 1.2 HCC细胞培养及亚砷酸钠处理HCC细胞
HuH7、HepG2、Hep3B和SMCC-7721细胞在10% FBS的DMEM培养液,37 ℃、5% CO2、饱和湿度的培养箱中孵育,细胞汇合度达到70%~80%时采用0.25%胰酶消化细胞进行实验。将普通培养HCC和原代HCC细胞经0.1~1.0 μg/mL终浓度亚砷酸钠处理。 1.3 肿瘤球培养
以无血清DMEM/F12(1 ∶1)基础培养基,加入EGF(10 ng/mL)、bFGF(20 μg/mL)、N2、B27等制成标准培养基,于超低粘附6孔板加入3 mL标准培养基和5.0×103个 HCC细胞,在37 ℃、5%CO2、饱和湿度的培养箱中孵育,每日半量换新鲜培养基,观察记录细胞球情况。 1.4 流式细胞术检测HCC细胞CD13、CD133分子表达
将普通培养条件下培养的4种HCC细胞常规消化后制成单细胞悬液,进行细胞计数,PBS洗2遍,分别装入1.5 mL EP管中,设置空白对照管、CD13、CD133、CD13-CD133双抗体4组,每管中加入5 μL抗体,4 ℃避光孵育30 min,700 r/min离心5 min弃上清,PBS洗3遍,300 μL PBS重悬细胞,流式细胞仪检测CD13、CD133分子表达。 1.5 CCK-8分析亚砷酸钠对HCC细胞抑制作用
HCC细胞接种于96孔板,每孔加1.0×103个细胞,加入100 μL 10% FB S的DMEM培养基(每2天换液)使其贴壁生长。次日细胞贴壁后分别加入不同浓度亚砷酸钠(0.1、0.2、0.4、0.6、0.8、1.0 μg/mL),每种浓度设12个孔,设调零孔12个(不加细胞)和细胞对照孔12个(不加药物),在37 ℃、5%CO2、饱和湿度的培养箱中孵育48、72、96 h后吸出培养液。每孔分别加入90 μL DMEM培养基和10 μL CCK-8溶液,继续培养2 h,在酶标仪波长450 nm处测定光密度值[D(450)]。 1.6 Western blot检测HCC细胞Oct4和Sox2的表达
①HCC细胞准备:HCC常规胰酶消化制成细胞悬液,细胞数1.0×106/mL,1 500 r/min离心5 min,移入1.5 mL EP管,PBS洗2次。②细胞总蛋白提取:细胞悬液离心吸尽上清液,加入200 μL蛋白酶抑制剂的裂解 液,冰上裂解30 min,4 ℃ 12 000 r/min 离心15 min,上清液移入EP管,蛋白定量后蛋白上样缓冲液稀释,煮3 min,分后置-20 ℃备用。③配胶:配置10%分离胶和4%积层胶。④上样和电泳:上样量为每泳道50 μg,体积25~30 μL。电泳,积层胶电压80 V,分离胶电压100~120 V,电泳2~3 h。⑤电转印:切胶后PADV膜向正极,胶在负极,将滤纸、PVDF膜及凝胶整齐重叠后放在湿转槽、电流150 mA转移90 min。⑥杂交:取下PVDF膜,5%脱脂奶粉PBS 封闭,室温振摇1~2 h。将封闭的膜滴加一抗按1 ∶100(3% BSA)、 4 ℃ 湿盒内过夜,次日PBS漂洗15 min×1次,5 min× 4次,二抗按1 ∶2 500(3%BSA)、25 ℃振摇1 h,PBS漂洗15 min×1次,5 min×4次。⑦化学试剂显色:混合等体积A液和B液(各500 μL,共1 mL),将显色剂滴加到PVDF膜正面,开始显色记录图像。 1.7 免疫荧光检测HuH7细胞Oct4和Sox2因子
0.5 μg/mL亚砷酸钠处理3 d的HuH7细胞和HuH7细胞普通培养在10 mm盖玻片上,长到60%用37 ℃预热PBS漂洗2次,4%多聚甲醛室温固定15 min,PBS洗5 min后用0.5% Triton X-100的PBS室温下脱色摇床振摇15 min,PBS洗3次。取出盖玻片放到载玻片上,10%山羊血清37 ℃封闭30 min,Oct4抗体用PBS按1 ∶50滴加15~20 μL到盖玻片上,湿盒内4 ℃冰箱过夜。有细胞的盖玻片放进24孔板,PBS脱色摇床洗3次,取出盖玻片滴加20 μL PBS 1 ∶50稀释的荧光抗体,37 ℃避光孵育60 min。盖玻片放进24孔板内,经PBS洗3次,Hoechst33342染色细胞核,PBS洗盖波片2次,取出盖玻片,封片后激光共聚焦显微镜下观察细胞Oct4和Sox2蛋白的表达。 1.8 定量PCR分析HuH7和原代细胞Oct4和Sox2基因表达
①用TRIzol Reagent提取HCC细胞总RNA。②逆转录:按BioKT cDNA first strand cynthesis Kit使用说明设置20 μL反应体系,在室温10 min,42 ℃ 45 min,95 ℃ 5 min,冰浴5 min。逆转录后cDNA在-20 ℃保存。③引物序列:GAPDH上游引物:5′-CCACCACC-CTGTTGCTGTAG-3′,下游引物5′-CCCACTCCTCCACCTTTGAC-3′,片段大小108 bp;Oct4上游引物:5′-GGCTCGAGAAGGATGTGGTC-3′,下游引物:5′-GAAG-TGAGGGCTCCCATAGC-3′,片段大小188 bp;Sox2上游 引物:5′-CAGGAGTTGTCAAGGCAGAGA-3′,下游引物:5′-CGCCGCCGATGATTGTTATT-3′,片段大小171 bp。④荧光定量PCR:按Promega GoTaq qPCR Master Mix Kit使用说明,20 μL体系,ABI7500荧光定量PCR仪进行反应。预变性 95 ℃4 min,95 ℃ 30 s,55 ℃ 20 s,72 ℃ 20 s,反应40个循环。 1.9 统计学处理
数据以x±s表示,采用SPSS 13.0统计软件行单因素方差分析。 2 结果 2.1 亚砷酸钠抑制SMCC-7721、HepG2、Hep3B和HuH7细胞生长
亚砷酸钠处理HCC细胞48 h(图 1),0.4 μg/mL 亚砷酸钠开始抑制SMCC-7721细胞生长(P<0.05),0.6 μg/mL 亚砷酸钠非常明显抑制SMCC-7721(P<0.01)、HepG2(P<0.01)和Hep3B(P<0.01)细胞增殖。0.1~0.8 μg/mL亚砷酸钠刺激HuH7细胞增殖,但差异无统计学意义(P>0.05),1.0 μg/mL亚砷酸钠非常明显抑制HuH7细胞增殖(P<0.01)。亚砷酸钠作用HCC细胞72 h(图 2),0.4 μg/mL亚砷酸钠非常明显抑制SMCC-7721(P<0.01)、HepG2(P<0.01)和Hep3B(P<0.01)细胞增殖。0.1~0.6 μg/mL亚砷酸钠刺激HuH7细胞增殖,但差异无统计学意义 (P>0.05),而0.8 μg/mL亚砷酸钠非常明显抑制HuH7细胞增殖(P<0.01)。亚砷酸钠处理HCC细胞96 h(图 3),0.2、0.4 μg/mL亚砷酸钠明显抑制SMCC-7721细胞生长(P<0.05,P<0.01)。0.4 μg/mL亚砷酸钠明显抑制HepG2(P<0.01)和Hep3B(P<0.01)细胞增殖。0.1~0.6 μg/mL亚砷酸钠刺激HuH7 细胞增殖,但差异无统计学意义(P>0.05),0.8 μg/mL 亚砷酸钠非常明显抑制HuH7细胞增殖(P<0.01)。抑制实验结果显示,亚砷酸钠处理HCC细胞48、72、96 h,低浓度亚砷酸钠对SMCC-7721、HepG2和Hep3B细胞几乎无刺激增殖作用,表明其低浓度就开始抑制其增殖;而亚砷酸钠对HuH7细胞存在低浓度刺激HuH7细胞增殖和较高浓度抑制HuH7细胞增殖的双向作用,随着作用时间延长,相同浓度下抑制作用增强。这证实亚砷酸钠抑制4种HCC细胞生长,0.4 μg/mL 亚砷酸钠明显抑制HepG2、Hep3B和SMCC-7721细胞生长,0.8 μg/mL 亚砷酸钠明显抑制HuH7细胞增殖,HuH7细胞对亚砷酸钠耐受能力最强。
 |
| a:P<0.05,b:P<0.01,与0 μg/mL比较 图 1 亚砷酸钠处理48 h SMCC-7721、HepG2、Hep3B和HuH7细胞生长抑制情况 |
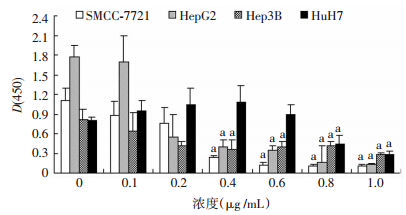 |
| a:P<0.01,与0 μg/mL比较 图 2 亚砷酸钠处理72 h SMCC-7721、HepG2、Hep3B和HuH7细胞生长抑制情况 |
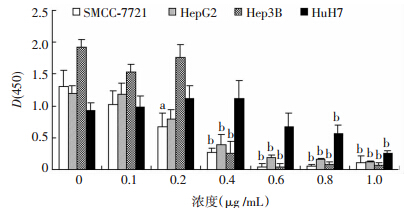 |
| a:P<0.01,与0 μg/mL比较 图 3 亚砷酸钠处理96 h SMCC-7721、HepG2、Hep3B和HuH7细胞生长抑制情况 |
流式细胞双标技术检测结果显示,HepG2、Hep3B 和SMCC-7721不表达LCSCs的标志CD133分子,Hep3B和SMCC-7721表达CD13抗原。HuH7和原代HCC细胞同时表达CD133、CD13标志,含有CD133+CD13+HCC细胞。SMCC-7721、HepG2和Hep3B细胞不能形成肿瘤球,HuH7和原代HCC细胞形成典型肿瘤球(图 4、5)。这提示HuH7和原代HCC细胞含LCSCs。
 |
| A:HepG2细胞既不表达CD13,也不表达CD33;B:Hep3B细胞仅表达少量CD13,不表达CD133;C:SMCC-7721细胞表达CD13较多,不表达CD133;D:HuH7细胞表达CD13和CD133;E:原代HCC细胞表达CD13和CD133 图 4 流式细胞双标技术检测HCC细胞株和原代HCC细胞CD13和CD133分子表达 |
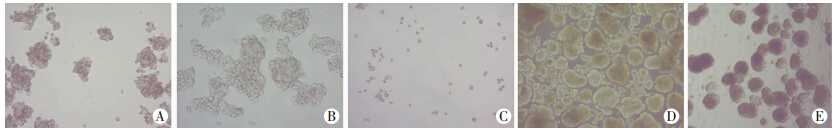 |
| A:HepG2;B:Hep3B;C:SMCC-7721;D:HuH7;E:原代HCC 图 5 HCC细胞株和原代HCC细胞肿瘤球形成(倒置显微镜 ×200) |
为了观察亚砷酸钠是否下调HCC细胞Oct4蛋白的表达,我们用含0.5 μg/mL亚砷酸钠处理HuH7和原代HCC细胞5 d,分析HuH7和原代HCC细胞Oct4蛋白表达变化,亚砷酸钠处理后HuH7和原代HCC细胞Oct4蛋白表达明显下调,HuH7细胞表达Oct4蛋白颗粒明显减少。HuH7和原代HCC细胞表达Sox2蛋白,亚砷酸钠处理后HuH7和原代HCC细胞蛋白表达明显下调(图 6、7)。
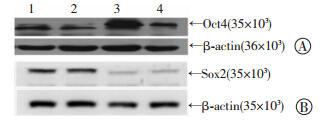 |
| 1:原代HCC细胞处理前;2:原代HCC细胞处理后;3:HuH7细胞处理前;4:HuH7细胞处理后 图 6 Western blot 检测亚砷酸钠处理前后HuH7和原代HCC细胞Oct4(A)和Sox2(B)蛋白的表达 |
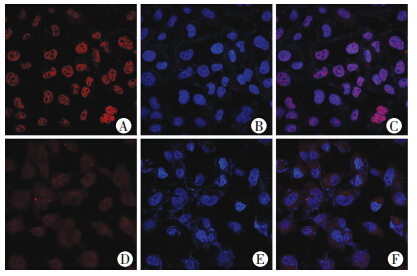 |
| A、D:表达Oct4蛋白的细胞核;B、E:被Hoechst33342染色的细胞核;C、F:Oct4和Hoechst33342图像重合;A~C:HuH7对照细胞,核形态正常,表达Oct4蛋白的细胞核形态清晰;D~F:经亚砷酸钠处理HuH7细胞,细胞核形态多变,核内Oct4蛋白明显减少,仅见浅红色核 图 7 免疫荧光观察亚砷酸钠处理前后HuH7细胞核内Oct4蛋白的表达(激光共聚焦显微镜 ×400) |
定量PCR分析结果显示,HuH7和原代HCC细胞表达Oct4、Sox2基因,0.5 μg/mL亚砷酸钠处理HuH7和原代HCC细胞5 d后HuH7和原代HCC细胞Oct4和Sox2基因表达明显下调(P<0.05,图 8)。
 |
| 1:HuH7细胞处理前;2:HuH7细胞处理后;3:原代HCC细胞处理前;4:原代HCC细胞处理后 a:P<0.05,与处理前比较 图 8 定量PCR检测亚砷酸钠处理前后HuH7和原代HCC细胞Oct4(A)和Sox2(B)基因的表达 |
HCC恶性程度高,切除后易复发转移,临床疗效差的根源是缺乏有效清除针对放化疗抵抗、处于休眠状态的LCSCs的方法。本研究发现0.6 μg/mL低浓度亚砷酸钠作用48 h就能非常显著抑制HepG2、 Hep3B和SMCC-7721增殖(P<0.01),而0.1~0.8 μg/mL 刺激HuH7细胞增殖,1.0 μg/mL亚砷酸钠明显抑制HuH7细胞增殖(P<0.01);亚砷酸钠处理HCC细胞72、96 h,0.4 μg/mL低浓度亚砷酸钠就能非常显著抑制HepG2、Hep3B和SMCC-7721增殖(P<0.01), 而亚砷酸钠浓度达到0.8 μg/mL时才能非常明显抑制HuH7 细胞增殖(P<0.01),0.1~0.6 μg/mL 反而刺激HuH7细胞增殖(P>0.05)。以上提示:①亚砷酸钠对HepG2、Hep3B、HuH7和SMCC-7721细胞都有明显的抑制作用,但HCC细胞抑制增殖作用存在浓度的差异;②亚砷酸钠对HCC细胞抑制作用随时间延长,相同浓度下抑制作用增强;③亚砷酸钠对HuH7细胞存在抑制和刺激增殖的双向作用,低浓度短期刺激增殖可能与早幼粒细胞白血病蛋白(PML)表达下调后,PML蛋白对肿瘤抑制作用减弱有关;对HuH7抑制是PML缺失后Oct4、Sox2等基因表达抑制的结果。既然亚砷酸钠对HepG2和SMCC-7721增殖具有明显抑制作用,为何Ⅱ期临床试验结果显示单独使用亚砷酸钠抗癌效果很不理想[6]?我们比较HepG2、Hep3B、SMCC-7721、HuH7和原代HCC细胞CD133、CD13标志的表达、肿瘤球形成和对亚砷酸钠的反应,发现3个差异:①HepG2、Hep3B、SMCC-7721细胞几乎不表达CD133分子,HuH7及原代HCC细胞同时表达CD133、CD13标志。研究已证实CD133+CD13+HCC细胞具有LCSCs的生物学特征[3, 7]。②HepG2、Hep3B、SMCC-7721细胞不能形成肿瘤球,HuH7和原代HCC细胞具有成瘤能力,后者具备自我更新能力。③0.2、0.4 μg/mL低浓度亚砷酸钠非常显著抑制HepG2、Hep3B和SMCC-7721增殖(P<0.01),0.8 μg/mL亚砷酸钠才明显抑制HuH7细胞增殖(P<0.01)。这些差异的关键是因为HuH7细胞含有CD13+CD133+HCC,原代HCC与HuH7细胞具有CD13+CD133+HCC和成球能力,因此,用抑制Hep3B、HuH7和SMCC-7721的低浓度亚砷酸钠治疗HCC,不仅不会抑制HCC细胞生长,反而会刺激HCC细胞生长。
Oct4基因特异表达于胚胎干细胞(embryonic stem cells,ESCs)及癌干细胞(cancer stem cells,CSCs)、早期胚胎、生殖细胞,Oct4不表达于已分化的细胞,是维持CSCs、ESCs自我更新、多能性和分化命运的关键因子[8, 9, 10]。Sox2表达于畸胎瘤细胞、胚胎内细胞团、外胚层和生殖细胞中 ,在维持ESCs和CSCs多能性和决定其是否走向分化方面具有关键作用,常作为一种多能性细胞谱系的分子标记,Oct4、Sox2协同调控干细胞增殖和分化关键基因的表达[11, 12]。本研究发现HuH7和原代HCC细胞表达Oct4和Sox2基因和蛋白,0.5 μg/mL 亚砷酸钠短时间(96 h)虽不能明显抑制HuH7细胞增殖,但可使HuH7和原代HCC细胞Oct4和Sox2蛋白及基因表达明显下调,提示低浓度亚砷酸钠可以抑制HuH7和原代HCC细胞Oct4和Sox2基因表达。这些结果提示0.5 μg/mL浓度亚砷酸钠不能明显抑制HuH7细胞增殖,却可抑制含CD133+CD13+HCC细胞的HuH7和原代HCC细胞Oct4和Sox2基因及蛋白的表达,表明Oct4和Sox2蛋白下调后CD133+CD13+LCSCs多能性难以维持,诱导分化为HCC细胞[13]。目前在临床HCC常规治疗不能针对性清除LCSCs,基础研究未找到防治HCC手术切除后复发和转移方法的情况下,本实验为临床HCC治疗过程中用低浓度砷剂抑制LCSCs关键基因表达,诱导LCSCs分化、清除LCSCs提供了新思路。我们尚需进一步研究亚砷酸钠通过何种途径抑制LCSCs关键基因Oct4和Sox2表达,如何影响LCSCs功能特征和LCSCs关键基因Oct4、Sox2表达。
| [1] | Llovet J M, Burroughs A, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2003, 362(9399): 1907-1917. |
| [2] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4): 225-249. |
| [3] | Haraguchi N, Ishii H, Mimori K, et al. CD13 is a therapeutic target in human liver cancer stem cells[J]. J Clin Invest, 2010, 120(9): 3326-3339. |
| [4] | Chen Y, Yu D, Zhang H, et al. CD133+EpCAM+ phenotype possesses more characteristics of tumor initiating cells in hepatocellular carcinoma Huh7 cells[J]. Int J Biol Sci, 2012, 8(7): 992-1004. |
| [5] | Zhang X W, Yan X J, Zhou Z R, et al. Arsenic trioxide controls the fate of the PML-RARalpha oncoprotein by directly binding PML[J]. Science, 2010, 328(5975): 240-243. |
| [6] | 屈凤莲, 郝学志, 秦叔逵, 等. 亚砷酸注射液治疗原发性肝癌的Ⅱ期多中心临床研究[J]. 中华肿瘤杂志, 2011, 33(9): 697-701. |
| [7] | 金世龙, 黄中荣, 陈华, 等. HuH7细胞系CD13+CD133+HCC细胞分选及CSCs特性分析[J]. 第三军医大学学报, 2012, 34(16): 1658-1662. |
| [8] | Ito K, Bernardi R, Morotti A, et al. PML targeting eradicates quiescent leukaemia-initiating cells[J]. Nature, 2008, 453(7198): 1072-1078. |
| [9] | Chang F T, McGhie J D, Chan F L, et al. PML bodies provide an important platform for the maintenance of telomeric chromatin integrity in embryonic stem cells[J]. Nucleic Acids Res, 2013 , 41(8): 4447-4458. |
| [10] | Karwacki-Neisius V, Goke J, Osomo R, et al. Reduced Oct4 expression directs a robust pluripotent state with distinct signaling activity and increased enhancer occupancy by Oct4 and Nanog[J]. Cell Stem Cell, 2013, 12(5): 531-545. |
| [11] | Koo B S, Lee S H, Kim J M, et al. Oct4 is a critical regulator of stemness in head and neck squamous carcinoma cells[J]. Oncogene, 2014, doi: 10. 1038/onc. 2014. 174. [Epub ahead of print]. |
| [12] | Boumahdi S, Driessens G, Lapouge G, et al. SOX2 controls tumour initiation and cancer stem-cell functions in squamous-cell carcinoma[J]. Nature, 2014, 511(7508): 246-250. |
| [13] | 金世龙, 余天雾, 黄中荣, 等. As2O3在HuH7及CD13+CD133+LCSCs增殖和分化中作用的初步观察[J]. 第三军医大学学报, 2012, 34(18): 1857-1861. |



