结直肠癌是全球高发的恶性肿瘤之一,随着国人生活水平的提高和饮食结构的变化,其发病率不断上升[1]。近年来,随着肿瘤表观遗传学的发展,DNA甲基化异常在结直肠癌的发生、发展中扮演着重要角色[2]。而有关抑癌基因的失活分子机制主要有三种:即缺失、突变、表观遗传学修饰(主要是启动子区甲基化修饰)。RECK基因抑制肿瘤转移已在多种肿瘤中被证实[3],而RECK基因表达下降与DNA启动子区异常甲基化有关[4, 5],已有研究证实腺苷在治疗癫痫过程中的机制与降低、逆转异常甲基化有关。针对肿瘤DNA甲基化异常的去甲基化和靶向甲基化已成为目前抗肿瘤治疗中探索的热点[6],但该领域的现有研究仍缺乏突破。本研究使用腺苷处理结直肠癌SW480细胞,观察其生长增殖影响,探讨其抗肿瘤效应及可能的机制。 1 材料与方法 1.1 主要材料及仪器
腺苷购于美国Sigma公司;人结直肠癌细胞(SW480)株由重庆医科大学生命科学研究院保存;胎牛血清、兔RPMI 1640培养基来源于美国Hyclone公司;抗人hMLH1单抗来源于美国Eptomic公司;DNA提取试剂盒、逆转录-PCR试剂盒来源于日本TaKaRa公司;9700基因扩增仪来源于美国ABI公司;凝胶成像系统来源于美国Bio-Rad公司;山羊抗兔二抗购于北京中杉金桥公司。 1.2 方法 1.2.1 细胞培养
将人结直肠癌SW480细胞株用含10%胎牛血清、1%青-链霉素双抗的RPMI1640培养基于5%CO2饱和湿度、37 ℃条件下培养。将对数生长期的SW480细胞取出,用3.0 mmol/L的腺苷干预细胞,每24小时更换药物培养基,对照组以相同体积不含药物的培养基培养,将干预后的细胞收集进行实验。 1.2.2 流式细胞仪检测细胞凋亡率
使用3.0 mmol/L 浓度腺苷干预SW480细胞72 h后,使用磷酸盐缓冲液(PBS)将其洗涤3次,将200 μL结合缓冲液重悬于流式管中,加入5 μL膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和5 μL碘化丙锭(PI)与100 μL细胞悬液混匀后,避光孵育15 min后,上机检测。各组实验重复3次。 1.2.3 硫酸氢盐测序(BSP)法检测RECK基因启动子区甲基化
按1.2.1方法处理SW480细胞后,使用提取试剂盒提取DNA,紫外分光光度计测定DNA浓度,将亚硫酸盐处理后的DNA进行扩增,扩增引物上游:5′-AGTTGGGTTATAATAAAGAGTTTTGG-3′,扩增长度为58 bp;引物下游:5′-TAAACCAAACCCCCTA-CCAC-3′,扩增长度为 314 bp,于94 ℃ 45 s,66 ℃ 45 s,72 ℃ 1 min环境中扩增,共20个循环,再修复延伸72 ℃ 8 min。产物行琼脂糖电泳,回收扩增产物连接载体,提取质粒后分别选取5个克隆位点进行甲基化测序,检测其甲基化状态。 1.2.4 RT-PCR法检测RECK基因mRNA的表达
按1.2.1方法处理SW480细胞后,将腺苷干预前后细胞总RNA采用TRIzol法提取,逆转录反应得到cDNA;将新合成的cDNA为模板进行PCR扩增。RECK扩增引物上游序列5′-CCAGATTATTGCCCA-GAGACA-3′;RECK扩增引物下游序列:5′-AGCCAGTTCACAGCAGCCTA-3′,扩增长度为114 bp。使用内参β-肌动蛋白扩增上游序列:5′-CCACTGGCATCGTGATGGAC-3′,β-肌动蛋白扩增下游序列:5′-GCGGATGTCCACGTCACACT-3′,扩增产物长度为423 bp。设置反应参数:94 ℃ 30 s,64 ℃ 30 s,72 ℃ 30 s环境中扩增,共38个循环,再72 ℃,5 min做终延伸。将PCR产物以5%琼脂糖凝胶电泳分离,胶成像系统成像。以目的基因与β-肌动蛋白条带的吸光度比值进行目的基因mRNA表达量半定量分析,重复实验3次。 1.2.5 Western blot检测RECK基因及DNMTs蛋白的表达
SW480细胞处理同1.2.1,BCA测定蛋白浓度,取等量蛋白进行电泳,电转至转膜至聚偏氟乙烯(PDVF)膜,5%脱脂牛奶的TBST室温封闭2 h。将稀释的兔抗人单克隆一抗(RECK按1 ∶300稀释; DNMT1 按1 ∶1 000稀释;DNMT3a按1 ∶1 000稀释;β-actin 按1 ∶20 000稀释)置于4 ℃环境孵育过夜,PBST洗膜3次,PBST洗膜后以暗室化学发光法凝胶成像系统显影。以目的蛋白/β-actin光密度比值进行蛋白表达量半定量分析。重复实验3次。 1.3 统计学分析
计量资料以x±s表示,采用SPSS 20.0统计软件进行独立样本t检验。 2 结果 2.1 腺苷对RECK基因甲基化状态的影响
RECK基因BSP扩增片段包括35个CpG岛,RECK基因克隆测序结果显示(图 1),3.0 mmol/L腺苷组的CpG岛的甲基化程度明显降低,甲基化频率为(49.14±2.38)%,低于对照组[(74.84±2.38)%,P<0.01]。
 |
| A:对照组;B:3.0 mmol/L腺苷组 ●:甲基化;○:非甲基化 图 1 BSP法检测各组细胞RECK基因甲基化状态 |
RT-PCR结果显示(图 2),3.0 mmol/L腺苷组mRNA表达量为0.335 3±0.350 2,明显高于对照组(0.080 0±0.003 6,P<0.01)。
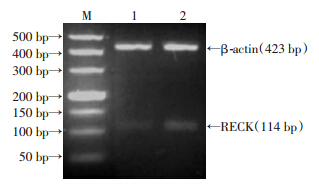 |
| M:标准;1:对照组;2:3.0 mmol/L腺苷组 图 2 RT-PCR检测腺苷干预后RECK 基因mRNA的表达 |
Western blot法检测腺苷对RECK蛋白、甲基转移酶DNMT1、DNMT3a蛋白的影响,每组均有蛋白表达,同时可见灰度一致的相对分子质量43 000的β-肌动蛋白内参条带(图 3)。腺苷干预后甲基转移酶(DNMT1、 DNMT3a)蛋白表达均明显低于对照组(0.141 3± 0.002 1 vs 0.645 0±0.009 2,0.130 0±0.004 6 vs 0.526 7±0.009 5,P<0.01);RECK基因蛋白表达水平明显高于对照组(0.603 0±0.017 8 vs 0.090 0±0.003 0,P<0.01)。
 |
| 1:对照组;2:3.0 mmol/L腺苷组 图 3 蛋白印迹法检测腺苷干预SW480细胞后蛋白表达情况 |
流式细胞仪检测结果显示(图 4),3.0 mmol/L腺苷组细胞凋亡率为(27.90±2.32)%,明显高于对照组[(5.09±0.30)%,P<0.01]。
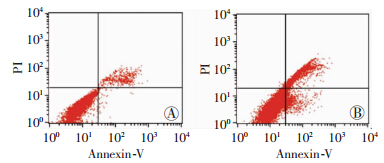 |
| A:对照组;B:3.0 mmol/L腺苷组 图 4 流式细胞仪检测各组细胞凋亡率 |
结直肠癌是发生于结直肠部位常见的消化道恶性肿瘤,发生率与病死率居第二位[7],目前主要以手术治疗为主,再辅以化疗、免疫治疗等综合治疗。表观遗传学修饰DNA甲基化目前已成为肿瘤分子生物学研究的热点之一[8]。已有研究证实腺苷通过减低或逆转异常甲基化从而起到治疗癫痫的作用[9],该领域的研究可能对提高结直肠癌整体治疗具有重要作用。
DNA甲基化是一种常见的表观遗传学修饰,其由DNA甲基转移酶(DNMTs)催化并以S-腺苷甲硫氨酸(SAM)作为甲基供体,将SAM转换成S-高半胱氨酸(SAH),同时使DNA相应片段甲基化。与在3′端的鸟嘌呤形成甲基化的CpG,于双链中对称出现。人类基因组中,胞嘧啶(C)与鸟嘌呤(G)的总和超过四种碱基的总和的50%,这种CpG序列称为CpG岛,基因调控存在于此,其甲基化水平将影响基因的表达[10, 11, 12]。DNA甲基化与基因表达调控关系密切,研究表明维持甲基化模式酶的调节失控和正常非甲基化CpG岛的高甲基化状态是人类肿瘤中存在的普遍现象[13],对于结直肠癌DNA甲基化方面的研究已成为目前结直肠癌的前沿研究热点。
腺苷广泛存在于全身组织细胞中,是腺嘌呤核苷酸的前体又是其代谢产物,可由甲基化环节中的S-高半胱氨酸水解后产生,即由SAH水解酶水解生成腺苷和高半胱氨酸[2]。腺苷也通过底物效应及通过反馈抑制调节影响关键酶的活性来对甲基化过程产生逆向调节[14]。值得注意的是腺苷也能由能量代谢中ATP逐级脱磷酸生成AMP,AMP大部分在5-核苷酸酶作用下生成腺苷,并在脉管系统增生和高代谢状态的肿瘤组织中相对聚集,故而肿瘤组织细胞对腺苷调节环节更为敏感,这为腺苷干预抗癌效应提供了可能性。
DNA甲基转移酶(DNMTs)是DNA甲基化过程中的关键酶,催化DNA甲基化的主要有三种酶:DNMT1、 DNMT2、DNMT3a、DNMT3b以及它们的亚型。DNMT1的功能是从头和维持甲基化的功能,广泛存在于哺乳动物中,且在哺乳动物中与X染色体失活及基因组印迹中发挥着重要作用[15],使半甲基化的双链DNA变成完全甲基化的双链DNA 。DNMT1与DNA的复制直接相关,甲基化的重要因素之一即是其过表达,与正常组织相比,DNMT1会影响肿瘤组织,使其在肿瘤组织中稳定性增强、半衰期延迟、产生突变,最显著的改变是其量的剧增,已有研究证实在胃癌、卵巢癌、肝癌等肿瘤组织中均显示DNMT1高表达[16]。DNMT3a和DNMT3b则主要是参与DNA的从头甲基化,催化非甲基化DNA成为甲基化状态的DNA;DNMT2具有催化区域,可与DNA上的特异位点结合,但其没有完整调节区域,而不具备甲基转移酶的活性[17]。有研究发现DNMT1、DNMT3a在肿瘤组织中表达水平明显升高,这提示DNMT3a与肿瘤的异常甲基化有关,并参与肿瘤的发生、发展;DNMT3a在结直肠癌中也明显高于正常黏膜和腺瘤[18, 19]。现已有文献报道在多种肿瘤临床样本中均检测到DNMT1高表达:胃癌、肺癌、肝癌、卵巢癌和结直肠癌组织中DNMT1 mRNA表达水平上调[20, 21]。本研究中测量到腺苷干预后,甲基化过程中的关键酶DNMT1、DNMT3a均明显低于对照组,这说明腺苷抑制了关键酶的表达,从而一定程度的逆转异常甲基化过程。
RECK基因是最近发现的基质金属蛋白酶(Metalloproteinase,MMP)抑制基因,在肿瘤组织中低表达,与肿瘤的侵袭转移能力有关,在乳腺癌[22]、肺癌[23]、肝癌[24]等肿瘤中已得到证实。恶性肿瘤的侵袭与转移与肿瘤新生血管基底膜的降解有关,金属蛋白酶参与此过程,RECK基因编码一个膜糖蛋白,能够负性调节MMP-2、MMP-9的活性,抑制肿瘤血管的生成和转移[25]。有研究证实RECK基因的序列在肠道、前列腺、卵巢、睾丸中最为丰富,且在进化上高度保守和组织上广泛分布,说明该基因有着重要生物学功能[25]。本研究中腺苷干预SW480细胞后,其RECK基因甲基化程度明显降低,RECK基因的蛋白表达恢复,进而恢复对细胞的控制,促进细胞凋亡,抑制肿瘤生长。
本研究通过3.0 mmol/L腺苷干预SW480细胞后,DNMT1及DNMT3a蛋白表达降低,RECK基因DNA启动子区甲基化水平降低,RECK基因mRNA及蛋白表达增强,通过流式细胞仪检测细胞凋亡发现腺苷干预后SW480细胞凋亡率明显增加。且本课题组在先前实验中已证实腺苷可逆转SW480细胞hMLH1基因启动子区异常甲基化状态,使该基因mRNA及其蛋白表达增加,促进细胞凋亡[26]。基于上述结果我们得出结论:腺苷干预SW480细胞后,抑制DNMTs的活性,使DNMTs蛋白表达降低,并在一定程度上逆转异常甲基化状态,使RECK基因的表达逐渐恢复,RECK基因mRNA及蛋白恢复表达从而促使SW480细胞凋亡,抑制肿瘤细胞的侵袭与转移。腺苷能使甲基转移酶活性降低,逆转启动子区异常甲基化从而使因甲基化而失活的抑癌基因重新激活,进而抑制肿瘤细胞的生长。本研究为肿瘤治疗的研究提供了新的思路和理论依据,对结直肠癌药物治疗方面有一定的指导作用,但肿瘤甲基化异常涉及许多基因,哪些基因起主导作用,逆转这些基因能否达到抑制肿瘤生长等问题有待进一步研究。
| [1] | Li G M. Mechanisms and functions of DNA mismatch repair[J]. Cell Res, 2008, 18(1): 85-98. |
| [2] | He C G, Huang Q Y, Chen L S, et al. p33ING1b methylation in fecal DNA as a molecular screening tool for colorectal cancer and precancerous lesions[J]. Oncol Lett, 2014, 7(5): 1639-1644. |
| [3] | Clark J C, Thomas D M, Choong P F, et al. RECK: a newly discovered inhibitor of metastasis with prognostic significance in multiple forms of cancer[J]. Cancer Metastasis Rev, 2007, 26(3/4): 675-683. |
| [4] | Paluszczak J, Misiak P, Wierzbicka M, et al. Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa[J]. Oral Oncol, 2011, 47(2): 104-107. |
| [5] | Correa T C, Brohem C A, Winnischofer S M, et al. Downregulation of the RECK-tumor and metastasis suppressor gene in glioma invasiveness[J]. J Cell Biochem, 2006, 99(1): 156-167. |
| [6] | Lewandowska J. Bartoszek A. DNA methylation in cancer development, diagnosis and therapy: multiple opportunities for genotoxic agengts to act as methylome disruptors or remediators[J]. Mutagenesis, 2011, 26(4): 475-487. |
| [7] | 陈琼, 刘志才, 程兰平, 等. 2003-2007年中国结直肠癌发病与死亡分析[J]. 中国肿瘤, 2012, 21(3): 179-182. |
| [8] | Center M M, Jemal A, Ward E. International trends in colorectal cancer incidence rates[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(6): 1688-1694. |
| [9] | Santos J C, Bastos A U, Cerutti J M, et al. Correlation of MLH1 and MGMT expression and promoter methylation with genomic instability in patients with thyroid carcinoma[J]. BMC Cancer, 2013, 13: 79. |
| [10] | Suzuki M M, Bird A. DNA methylation landscapes: provocative insights from epigenomics[J]. Nat Rev Genet, 2008, 9(6): 465- 476. |
| [11] | Zhang H, Li X, Ge L, et al. Methylation of CpG island of p14(ARK), p15(INK4b) and p16(INK4a) genes in coke oven workers[J]. Hum Exp Toxicol, 2014, pii: 0960327114533576. |
| [12] | Mahoney S E, Yao Z, Keyes C C, et al. Genome-wide DNA methylation studies suggest distinct DNA methylation patterns in pediatric embryonal and alveolar rhabdomyosarcomas[J]. Epigenetics, 2012, 7(4): 400-408. |
| [13] | Das P M, Singal R. DNA methylation and cancer[J]. J Clin Oncol 2004, 22(22): 4632-4642. |
| [14] | Kloor D, Osswald H. S-Adenosylhomocysteine hydrolase as a target for intracellular adenosine action[J]. Trends Pharmacol Sci, 2004, 25(6): 294-297. |
| [15] | Gu H, Book C, Mikkelsen T S, et al. Genome-scale DNA methylation mapping ofclinical samples at single-nucleotide resolution[J]. Nat Methods, 2010, 7(2): 133-136. |
| [16] | 胡兵, 安红梅, 沈克平.细胞衰老与肿瘤发生[J].生命科学, 2008, 20(3): 447-449. |
| [17] | Robertson K D. DNA methylation and chromatin-unraveling the tangled web[J]. Oncogene, 2002, 21(35): 5361-5379. |
| [18] | Adachi Y, Takeuchi T, Nagayama T, et al. T-cadherin modulates tumor-associated molecules in gallbladder cancer cells[J]. Cancer Invest, 2009, 28(2): 120-126. |
| [19] | Ciatto C, Bahna F, Zampieri N, et al. T-cadherin structures reveal a novel adhesive binding mechanism[J]. Nat Struct Mol Biol, 2010, 17(3): 339-347. |
| [20] | Jiang J, Cao X, Jia Z F, et al. AOSOP7 Role of polymorphisms of DNA methyltransferases in risks of gastric cancer and atrophic gastritis[J]. Eur J Cancer, 2012, 48(Suppl 4): S3. |
| [21] | Zhang Y, Chen F Q, Sun Y H, et al. Effects of DNMT1 silencing on malignant phenotype and methylated gene expression in cervical cancer cells[J]. J Exp Clin Cancer Res, 2011, 30: 98. |
| [22] | 沈波, 陈嘉, 郑马庆, 等.HER-2/neu与RECK mRNA在乳腺癌组织的表达及其意义[J]. 中华实验和临床病毒学杂志, 2012, 26(4): 279-281. |
| [23] | Chang H C, Cho C Y, Hung W C. Downregulation of RECK by promoter methylation correlates with lymph node metastasis in non-small cell lung cancer[J]. Cancer Sci, 2007, 98(2): 169-173. |
| [24] | Zhang C, Ling Y, Zhang C, et al. The silencing of RECK gene is associated with promoter hypermethylation and poor survival in hepatocellular carcinoma[J]. Int J Biol Sci, 2012, 8(4): 451-458. |
| [25] | Takahashi C, Sheng Z, Horan T P, et al. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK[J]. Proc Natl Acad Sci U S A, 1998, 95(22): 13221-13226. |
| [26] | 谢凯, 王亚旭, 申海鹰, 等. 腺苷对人结直肠癌细胞hMLH1基因甲基化的影响[J]. 中华医学杂志, 2014, 94(16): 1261-1264. |



