高强度聚焦超声(high-intensity focused ultrasound,HIFU) 是一种治疗实体肿瘤的非侵入性技术,其治疗肿瘤的原理是利用超声波具有良好的组织穿透能力并可以聚焦的物理特性,将体外电声换能器产生的多束 超声波聚焦于体内肿瘤病灶,使靶区温度在0.5~1.0 s 内达到 65~100 ℃,从而使靶区的肿瘤组织出现凝固性坏死而对靶区周围组织无明显影响,实现对实体瘤的无创性“切除”[1]。近年研究发现HIFU不仅能切除原发肿瘤,抑制肿瘤再生和远处转移,还可以增强机体抗肿瘤免疫[2, 3, 4]。然而,HIFU增强机体抗肿瘤免疫的机制尚不清楚。
机体抗肿瘤免疫反应主要是T细胞依赖性的细胞免疫反应。目前认为T细胞的活化需要双信号刺激:第l信号由T细胞抗原受体(TCR)与抗原提呈细胞 (APC)上的抗原肽—MHC分子复合物结合所提供;第2信号则由APC上的共刺激分子与T细胞上的相应配体结合所提供。研究表明,只有在双信号共同刺激下才能有效地激活T细胞,否则会导致T细胞免疫无能和凋亡[5, 6, 7]。而近年来,大量研究发现miRNAs在免疫细胞的产生、发育、免疫应答以及免疫耐受过程中均有着重要的作用[8, 9, 10, 11]。因此,我们假设HIFU可能通过调节miRNAs的表达从而增强机体抗肿瘤免疫。为此,我们构建了HIFU治疗黑色素瘤模型,证实HIFU可以诱导机体产生抗肿瘤免疫,进一步研究HIFU对miRNAs表达的影响,初步探讨miRNAs在HIFU增强机体抗肿瘤免疫中的作用,从而为HIFU治疗肿瘤的临床应用提供更多的实验依据和理论基础。 1 材料与方法 1.1 主要材料和仪器
6~8周龄雌性C57BL/6J近交系小鼠,体质量20~ 24 g,共60只(重庆医科大学实验动物中心),HIFU肿瘤治疗系统(重庆医科大学超声工程研究所),小鼠黑色素瘤B16细胞株(重庆医科大学超声工程研究所馈赠),人胚肾HEK293T细胞株(购于中国科学院上海细胞库),小鼠脾脏淋巴细胞分离液(天津灏洋生物制品责任有限公司),HE染液(上海恒远生物科技有限公司),鼠TNF-α和IFN-γ ELISA试剂盒(重庆博培公司),TRIzol(Invitrogen公司),SYBR Premix ExTaqTMⅡ荧光定量PCR试剂盒(大连TaKaRa公司),鼠抗鼠ICAM-1单克隆抗体(美国Santa Cruz公司),荧光素酶载体质粒pMIR-REPORTTM System(重庆医科大学检验医学院柳满然老师馈赠),miR-181a模拟物(miR-181a mimics)及阴性对照 (miR-NC)(上海吉玛公司),LipofectamineTM2000转染试剂 (美国Invitrogen公司)。 1.2 细胞培养及黑色素瘤动物模型的构建
B16细胞用含10%胎牛血清(Hyclone公司)、100 U/mL 青霉素和100 μg/mL链霉素的RPMI1640培养基(Hyclone公司)在37 ℃、5%CO2的条件下培养,待其贴壁生长至80%~90%融合率时,用含0.25%的胰酶消化,并制备单细胞悬液,调整其浓度为5×106/mL,取1×106/200 μL单细胞悬液皮下接种于C57BL/6J小鼠,待肿瘤最大直径至7 mm时开始行HIFU治疗。 1.3 动物分组及处理
将60只荷瘤鼠采用简单随机方法分为HIFU组与荷瘤组,每组 30只,HIFU组用9.3 MHz、4.5 W的HIFU肿瘤治疗系统进行辐照,单次照射10 s,总共照射120 s;荷瘤组进行假照处理。HIFU治疗后继续饲养20 d,每隔3 d用游标卡尺测量小鼠瘤体直径,计算瘤体体积,瘤体体积=(最小直径)2×(最大直径)/2。在HIFU治疗14 d时,每组处死20只小鼠,收集血液、脾脏及肿瘤组织备用。 1.4 HE染色
分离小鼠肿瘤组织,并进行石蜡包埋切片后行HE染色,具体操作按上海恒远生物科技有限公司操作说明书进行。 1.5 脾淋巴细胞与B16细胞共培养
采用小鼠脾脏淋巴细胞分离试剂盒分离小鼠脾淋巴细胞,将获得的脾淋巴细胞和B16细胞按20 ∶1的比例在含1%FBS的RPMI1640中混合,共孵育于96孔板,48 h后分离共培养上清液保存于-80 ℃冰箱备用,同时用MTT法检测存活的B16细胞,以酶标仪测D(492)值,以反映各组脾淋巴细胞对肿瘤细胞的相对杀伤活性。 1.6 ELISA检测
将上述各组小鼠血清及脾淋巴细胞与B16细胞共培养上清液于-80 ℃冰箱保存。ELISA方法检测TNF-α和IFN-γ的表达水平,按试剂盒说明书操作。 1.7 RNA提取和RT-PCR、qRT-PCR检测
使用TRIzol法提取总RNA,微量检测仪检测RNA的浓度,计算逆转录的RNA用量,即时进行cDNA转化;以合成的cDNA为模板进行qRT-PCR检测miRNAs的水平,RT-PCR检测ICAM-1的mRNA水平。 1.8 Western blot检测
提取脾淋巴细胞总蛋白,以100 μg/孔的量上样,进行SDS-PAGE电泳,湿转法将电泳产物转移到孔径为0.45 μm的PVDF膜,5%脱脂奶粉室温封闭2 h,滴加一抗(1 ∶1 000)4 ℃过夜,TBST洗膜15 min×3次,滴加二抗(1 ∶5 000) 37 ℃孵育2 h,TBST洗膜15 min×3次,按ECL试剂盒说明进行显色,GelDoc凝胶成像仪采集图像,通过Quantity-One软件分析获得各阳性条带的灰度值。 1.9 生物信息学预测miRNAs的靶基因
用miRBase、PicTar和TargetScan数据库预测差异miRNAs的靶基因。 1.10 构建荧光素酶报告质粒及荧光素酶报告基因实验
通过生物信息学方法预测到差异miRNAs的靶序列,并人工合成靶序列双链(靶基因的3′UTR和Mut 3′UTR)插入到载体质粒pMIR-REPORTTM System,经菌落PCR筛选阳性菌落扩增,质粒提取纯化后的产物进行HindⅢ和SpeⅠ双酶切及基因测序鉴定证实获得pLUC-ICAM-1-3′UTR及pLUC-ICAM-1-Mut 3′UTR后,大量抽提高纯度质粒,置-80 ℃冰箱保存备用。
将对数生长期293细胞种入24孔板,待细胞贴壁50%时,按照 LipofectamineTM2000转染试剂说明书将荧光素酶报告质粒和miR-181a mimics进行共转染,48 h 后检测荧光素酶活性。 1.11 统计学分析
数据以x±s表示,采用SPSS 17.0统计软件,组间差异采用单因素方差分析,均作双侧检验。 2 结果 2.1 HIFU治疗能够破坏肿瘤组织、抑制肿瘤生长和增强机体抗肿瘤免疫
HIFU治疗0 d时取出肿瘤组织,经HE染色显示HIFU治疗可以引起靶区肿瘤组织发生凝固性坏死(图 1A红色箭头示)而不影响周围其他组织。小鼠瘤体生长曲线显示,HIFU治疗11 d以后HIFU组瘤体体积明显小于荷瘤组,且随着饲养时间的延长,统计学差异更加明显(图 1B)。在HIFU治疗14 d时处死小 鼠,收集小鼠血液及脾脏组织。将纯化后的小鼠脾淋巴细胞与B16细胞进行体外共培养48 h,MTT法检测脾淋巴细胞对B16细胞的杀伤活性,结果显示HIFU组D(492)值明显低于荷瘤组(0.309±0.025 vs 0.338±0.019,P<0.05),即HIFU组脾淋巴细胞杀伤活性明显强于荷瘤组。 ELISA检测血清及共培养上清中TNF-α及IFN-γ的表达水平,结果发现HIFU组小鼠血清及共培养上清中IFN-γ的表达水平明显高于荷瘤组(P<0.05),TNF-α的表达水平较荷瘤组也有所升高(表 1)。
 |
| A:肿瘤组织HE染色(×100);B:瘤体生长曲线 a : P<0.05,b: P<0.01,与HIFU组比较 图 1 HIFU治疗对肿瘤组织及肿瘤生长的影响 |
| 组别 | IFN-γ(pg/mL) | TNF-α(ng/mL) | ||
| 血清 | 共培养上清 | 血清 | 共培养上清 | |
| 荷瘤组 | 34.0±12.1 | 53.4±11.8 | 65.0±11.3 | 105.6±11.1 |
| HIFU组 | 59.7±11.5a | 79.0±10.2a | 73.6±13.3 | 127.0±55.2 |
| a :P<0.05,与荷瘤组比较 | ||||
通过阅读文献筛选了6个与免疫密切相关的miRNAs:miR-34、miR-106a、miR-126a、miR-155、miR-181a和miR-221。qRT-PCR检测结果发现,HIFU组脾淋巴细胞中miR-155和miR-181a 的表达水平明显低于荷瘤组(P<0.05,P<0.01),miR-34的表达水平明显高于荷瘤组(P<0.05),其中miR-181a的表达差异最为显著(P<0.01,图 2)。miR-106a、miR-126a和miR-222的qRT-PCR结果显示Ct>35,在脾淋巴细胞中几乎不表达。
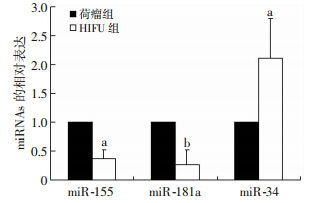 |
| a: P<0.05,b: P<0.01,与荷瘤组比较 图 2 qRT-PCR检测脾淋巴细胞中miRNAs的相对表达 |
利用生物信息学分析差异表达miRNAs的靶基因,发现miR-181a可以靶向作用于共刺激分子ICAM-1,因此,我们分别从基因及蛋白水平检测脾淋巴细胞中ICAM-1的水平。结果显示,HIFU组小鼠脾淋巴细胞中ICAM-1的mRNA(1.27±0.24,P<0.05,图 3A)及蛋白表达(1.69±0.60,P<0.01,图 3B)均明显高于荷瘤组。
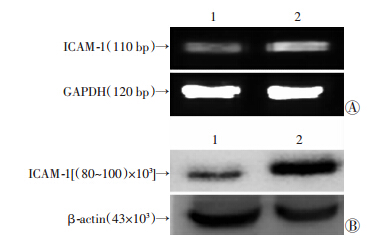 |
| A:RT-PCR检测ICAM-1的mRNA表达;B:Western blot检测ICAM-1的蛋白表达 1:荷瘤组;2:HIFU组 图 3 HIFU促进脾淋巴细胞中ICAM-1的mRNA及蛋白表达 |
人工合成的靶基因3′UTR和Mut 3′UTR被分别克隆到载体质粒pMIR-REPORTTM System,构建为荧光素酶报告质粒pLUC-ICAM-1-3′UTR和pLUC-ICAM-1-Mut 3′UTR(图 4A)。再将miR-NC和pLUC-ICAM-1-3′UTR、miR-181a mimics和pLUC-ICAM-1-3′UTR、miR-181a mimics和pLUC-ICAM-1-Mut 3′UTR分别共转染HEK293细胞,48 h后,裂解细胞并检测荧光素酶活性。结果显示,miR-181a mimics和pLUC-ICAM-1-3′UTR组的荧光强度相比对照组显著降低(P<0.01,图 4B),证实miR-181a mimics对pLUC-ICAM-1-3′UTR的表达有抑制作用,并且发挥该抑制功能是通过miR-181a mimics与pLUC-ICAM-1-3′UTR 3′UTR结合实现的,提示ICAM-1是 miR-181a的靶基因。
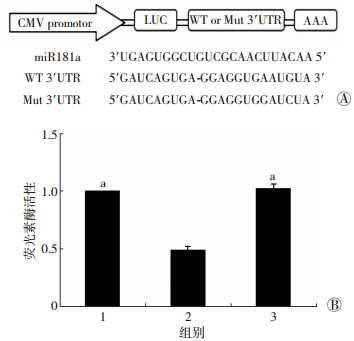 |
| A:荧光素酶报告质粒构建示意图;B:荧光素酶活性1:miR-NC和pLUC-ICAM-1-3′UTR;2:miR-181a mimics和pLUC-ICAM-1-3′UTR;3:miR-181a mimics和pLUC-ICAM-1-Mut 3′UTR;a: P<0.01,与miR-181a mimics和pLUC-ICAM-1-3′UTR比较 图 4 miR-181a mimics抑制pLUC-ICAM-1-3′UTR荧光素酶活性 |
为进一步证明miR-181a对共刺激分子ICAM-1的调控作用,我们分别用miR-NC及miR-181a mimics转染脾淋巴细胞,48 h后用RT-PCR和Western blot实验检测细胞中ICAM-1 mRNA和蛋白质水平。qRT-PCR结果显示,当转染miR-181a mimics后,细胞中miR-181a的表达水平相较于miR-NC组平均高出2 276倍,表明转染成功(P<0.01)。RT-PCR检测细胞中ICAM-1的mRNA水平,结果显示miR-181a mimics组(0.82±0.08)明显低于miR-NC组(P<0.05,图 5A);同时,ICAM-1蛋白质水平(0.65±0.44)也显著低于miR-NC组(P<0.01,图 5B)。表明在脾淋巴细胞中miR-181a可以下调ICAM-1的表达。
 |
| A:RT-PCR检测转染miR-181a mimics后ICAM-1的mRNA水平;B:Western blot检测转染miR-181a mimics后ICAM-1的蛋白水平 1:miR-NC组;2:miR-181a mimics组 图 5 miR-181a降低脾淋巴细胞中ICAM-1 mRNA和蛋白质水平 |
恶性肿瘤严重威胁着人类健康,有相当一部分患者死于肿瘤复发或转移。因此,在有效摧毁原发癌灶的同时增强机体抗肿瘤免疫、控制肿瘤复发和转移是提高患者预后的一条重要途径。近几年来,HIFU已逐渐成为治疗子宫肌瘤、前列腺癌、肝癌等实体肿瘤的有效手段之一,且周颦等[12]研究发现 HIFU在有效治疗局部肿瘤时,还可以诱发宿主抗肿瘤免疫功能的活化,诱导小鼠产生抗同源肿瘤的免疫力。然而,HIFU改善患者免疫功能的机制至今未明。
近年来相关研究表明miRNAs参与机体免疫应答与免疫耐受,如miR-155可以通过调控干扰素信号调节CD8+T细胞的反应[13],miR-126可以通过调节PI3K-AKT信号通路诱导和维持Treg细胞的免疫抑制功能[14],miR-222和miR-339通过抑制肿瘤细胞表面ICAM-1的表达从而下调CTL细胞对肿瘤细胞的杀伤活性[15]等。本研究前期结果显示,HIFU可以使靶区肿瘤组织出现凝固性坏死而对靶区周围组织无明显影响,进而抑制肿瘤生长,增加血液及共培养上清中TNF-α及IFN-γ的表达,明显增强脾淋巴细胞对肿瘤细胞的杀伤活性。这与国内外相关研究结果一致[16, 17],证实HIFU可以抑制原发肿瘤生长和增强机体抗肿瘤免疫力。此外,我们通过阅读文献筛选了6个与免疫密切相关的miRNAs:miR-34,miR-106a,miR-126a,miR-155,miR-181a和miR-221,研究HIFU对miRNAs表达的影响。结果显示HIFU可以调控脾淋巴细胞中miR-155,miR-34,miR-181a的表达,且通过生物信息学分析发现miR-181a可以靶向作用于ICAM-1。ICAM-1是免疫球蛋白超家族成员之一[18],属于共刺激分子中的一种,可分布在淋巴细胞、内皮细胞、单核细胞等多种细胞表面[19],其中APC表面的ICAM-1与T细胞表面受体淋巴细胞功能相关抗原-1(LFA-1)的特异性结合可协同促进淋巴细胞活化、增殖和分化,增强机体免疫应答[20]。因此,我们推测HIFU可以通过下调miR-181a的表达水平,调控脾淋巴细胞表面ICAM-1的表达,从而增强机体产生抗肿瘤免疫。
为初步验证假设,我们分别从基因及蛋白水平检测在HIFU治疗14 d时脾淋巴细胞中ICAM-1的表达含量。结果表明HIFU可以诱导增强脾淋巴细胞表达ICAM-1。那么,ICAM-1表达含量的增加与miR-181a下调之间是否存在相关性?为此,我们构建了pLUC-ICAM-1-3′UTR荧光素酶报告质粒,并根据实验结果得到初步结论,即miR-181a可以直接靶向作用于ICAM-1的3′-UTR。为进一步验证该结论,我们将miR-181a mimics转染脾淋巴细胞,发现miR-181a mimics可以明显下调脾淋巴细胞中ICAM-1的mRNA及蛋白水平,进一步确认miR-181a对共刺激分子ICAM-1具有负性靶向调控作用。
本研究表明,HIFU可增强荷瘤小鼠体内的抗肿瘤免疫能力,其机制可能是通过下调脾淋巴细胞中miR-181a的水平,抑制miR-181a对靶基因ICAM-1的负调控作用,增强淋巴细胞表面共刺激分子ICAM-1的表达,影响ICAM-1与T细胞表面受体LFA-1的特异性结合,促进淋巴细胞活化、增殖和分化来实现的。该实验虽然初步证实了miR-181a在HIFU增强机体抗肿瘤免疫力中的作用,但参与机体免疫应答的miRNAs较多,故在HIFU治疗过程中是否有其他miRNAs的参与仍需进一步探讨。
| [1] | 王智彪. 肿瘤治疗新方法-高强度聚焦超声肿瘤治疗技术[J]. 世界医疗器械, 1995, 5(11): 35-38. |
| [2] | Huang X, Yuan F, Liang M, et al. M-HIFU inhibits tumor growth, suppresses STAT3 activity and enhances tumor specific immunity in a transplant tumor model of prostate cancer[J]. PLoS One, 2012, 7(7): e41632. |
| [3] | Xia J Z, Xie F L, Ran L F, et al. High-intensity focused ultrasound tumor ablation activates autologous tumor-specific cytotoxic T lymphocytes[J]. Ultrasound Med Biol, 2012, 38(8): 1363-1371. |
| [4] | Xu Z L, Zhu X, Lu P, et al. Activation of tumor-infiltrating antigen presenting cells by high intensity focused ultrasound ablation of human breast cancer[J]. Ultrasound Med Biol, 2009, 35(1): 50-57. |
| [5] | Melero I, Bach N, Chen L. Costimulation, tolerance and ignorance of cytolytic T lymphocytes in immune responses to tumor antigens[J]. Life Sci, 1997, 60(23): 2035-2041. |
| [6] | Jindra P T, Bagley J, Godwin J G, et al. Costimulation-dependent expression of microRNA-214 increases the ability of T cells to proliferate by targeting Pten[J]. J Immunol, 2010, 185(2): 990-997. |
| [7] | Parameswaran N, Suresh R, Bal V, et al. Lack of ICAM-1 on APCs during T cell priming leads to poor generation of central memory cells[J]. J Immunol, 2005, 175(4): 2201-2211. |
| [8] | Chen C Z, Schaffert S, Fragoso R, et al. Regulation of immune responses and tolerance: the microRNA perspective[J]. Immunol Rev, 2013, 253(1): 112-128. |
| [9] | Vigorito E, Kohlhaas S, Lu D, et al. miR-155: an ancient regulator of the immune system[J] . Immunol Rev, 2013, 253(1): 146-157. |
| [10] | Podshivalova K, Salomon D R. MicroRNA regulation of T-lymphocyte immunity: modulation of molecular networks responsible for T-cell activation, differentiation, and development[J]. Crit Rev Immunol, 2013, 33(5): 435-476. |
| [11] | Bronevetsky Y, Ansel K M. Regulation of miRNA biogenesis and turnover in the immune system[J]. Immunol Rev, 2013, 253(1): 304-316. |
| [12] | 周颦, 苏立, 傅敏, 等. 高强度聚焦超声制备肿瘤疫苗对小鼠抗肿瘤免疫增强作用的研究[J]. 中国超声医学杂志, 2012, 28(7): 591-594. |
| [13] | Gracias D T, Stelekati E, Hope J L, et al. The microRNA miR-155 controls CD8(+) T cell responses by regulating interferon signaling[J]. Nat Immunol, 2013, 14(6): 593-502. |
| [14] | Qin A, Wen Z, Zhou Y, et al. MicroRNA-126 regulates the induction and function of CD4(+)Foxp3(+) regulatory T cells through PI3K/AKT pathway[J]. J Cell Mol Med, 2013, 17(2): 252-264. |
| [15] | Ueda R, Kohanbash G, Sasaki K, et al. Dicer-regulated microRNAs222 and 339 promote resistance of cancer cells to cytotoxic T-lymphocytes by down-regulation of ICAM-1[J]. Proc Natl Acad Sci USA, 2009, 106(26): 10746-10751. |
| [16] | den-Brok M H, Sutmuller R P, van-der-Voort R, et al. In situ tumor ablation creates an antigen source for the generation of antitumor immunity[J]. Cancer Res, 2004, 64(11): 4024-4029. |
| [17] | Wu F, Wang Z B, Lu P, et al. Activated anti-tumor immunity in cancer patients after high intensity focused ultrasound ablation[J]. Ultrasound Med Biol, 2004, 30 (9): 1217-1222. |
| [18] | Pietruczuk M, Pietruczuk A, Pancewicz S, et al. ICAM-1: structure, biological role and clinical significance[J]. Pol Merkur Lekarski, 2004, 17(101): 507-511. |
| [19] | van-de-Stolpe A, van-der-Saag P T. Intercellular adhesion molecule-1[J]. J Mol Med (Berl), 1996, 74(1): 13-33. |
| [20] | Gonzalez P A, Carreno L J, Cespedes P F, et al. Modulation of tumor immunity by soluble and membrane-bound molecules at the immunological synapse[J]. Clin Dev Immunol, 2013, 2013: 450291. |



