DNA双链断裂(double-strand break,DSB)是诸多DNA损伤类型中对基因组的完整、稳定性影响最大的一种损伤形式,众多内源性及外源性因素,如:活性氧自由基、V(D)J重组、离子射线及某些DNA损伤试剂均能诱导其产生;其修复过程的关键早期应答是组蛋白H2AX的磷酸化(γ-H2AX),该蛋白由H2AX基因 编码,其C端Ser139位点是PIKKs家族的磷酸化识别位点,能够被所有的3个PIKKs家族成员(包括DNA-PK、ATM 和ATR)磷酸化[1],并在DSB位点附近延伸0.5~2 Mbp范围。γ-H2AX在DSB损伤信号传导过程中扮演极其重要的角色,包括募集下游因子启动DNA修复、细胞周期检查点以及诱导凋亡等后续反应[1, 2]。
DNA-PKcs(DNA依赖的蛋白激酶催化亚单位)是DSB修复途径NHEJ(非同源末端连接)的关键因子,与Ku70/80二聚体一起,构成DNA依赖的蛋白激酶,募集其他修复相关蛋白到损伤位点。与同属PIKKs家族的ATM和ATR不同,它在DNA损伤信号传导途径中几乎不发挥作用,因此在DNA-PKcs缺陷细胞中,细胞周期检查点阻滞表现正常[3]。ATM由DSB激活,是DSB应答反应信号传导的重要组成,其磷酸化底物广泛,包括Chk1/2、Rad17、BRCA1、BLM、53BP1、MDC1等。ATR的功能及作用底物与ATM相似,在应对复制刺激,单链断裂和UV损伤时,H2AX主要由ATR进行磷酸化[4]; H2AX的磷酸化作用机制存在争议,长期以来,ATM被认为在磷酸化H2AX中占主导作用,或认为H2AX由DNA-PK和ATM共同作用进行磷酸化[3]。近年报道发现DNA-PKcs在磷酸化H2AX中发挥越来越重要的作用[5],本研究通过Ncs诱导DSB,Western blot检测γ-H2AX生成的时间和剂量依赖过程,及其去磷酸化的恢复过程,检测PIKK抑制剂对其生成的影响,并首次通过染色质免疫共沉淀(CHIP)检测,在PIKK抑制剂作用前后H2AX在中心粒DNA重复序列-α-satellite的磷酸化情况的变化,得出量化数据,为阐明H2AX磷酸化关键酶提供参考。 1 材料与方法 1.1 材料
Anti-H2AX、anti-pS2056兔抗人多克隆抗体(Abcam公司),anti-αtubulin(Santa Cruz公司),anti- pT2609(bioLegend公司),山羊抗小鼠和抗兔辣根过氧化物酶标记二抗(Jackson Lab公司),DSB诱导剂neocazinostartin (Ncs,Sigma公司)。 ATM抑制剂Ku55933和DNA-PKcs抑制剂Nu7026(Selleck公司)。CHIP试剂盒、SsoFast Evagreen supermix(Bio-Rad公司),α-satellite引物由Sigma合成:上游5′-TCATTCCCACAAACTGCGTTG-3′,下游:5′-TCCAACGAAGGCCACAAGA-3′,片段大小:136 bp。其他常用试剂及人宫颈腺癌HeLa细胞株由本实验室提供。 1.2 方法 1.2.1 DSB诱导时间剂量依赖及细胞恢复测试
培养HeLa细胞于DMEM培养液,添加10%胎牛血清及125 U青霉素和125 μg /mL链霉素,37 ℃、5% CO2条件下培养。以0、0.05、0.1、0.5、1 μmol/L neocarzinostatin(Ncs)作用1 h或以0.5 μmol/L Ncs作用细胞0、5、15、30 min或1 h。细胞恢复测试:取0.5 μmol/L Ncs,处理细胞30 min或1 h后,立即更换培养液,再继续培养0、1、2、4 h,并设置未处理对照。冰上收集细胞,行Western blot检测。 1.2.2 DNA-PKcs及ATM抑制实验
0、20、40、80 μmol/L DNA-PKcs抑制剂NU7026或ATM抑制剂Ku55933预处理细胞2 h,后以0.5 μmol/L Ncs作用细胞30 min,换液,细胞恢复0、1、2 h,并设置未处理对照。冰上收集细胞,行Western blot检测。 1.2.3 染色质免疫共沉淀(CHIP)
使用Bio-Rad CHIP试剂盒。细胞处理后,以1%甲醛作用10 min交联。0.125 mol/L甘氨酸作用5 min以中和。冷PBS洗2次,将细胞刮下,离心收集,置于冰上。顺序提取细胞质及细胞核,将细胞核提取液在冰上进行以超声处理,使染色质切断至100~600 bp,11 000×g离心5 min,收集上清液。将该染色质溶液以CHIP稀释液稀释10倍,后以琼脂糖珠作预清除(Bio-Rad,CHIP grade agarose beads),2 mL染色质稀释溶液+40 μL琼脂糖珠,4 ℃条件下,旋转孵育2 h。3 000×g离心5 min,收集上清液。取50 μg染色质/CHIP,加入γ-H2AX单抗,兔IgG用作阴性对照。CHIP反应在4 ℃下摇摆孵育过夜。琼脂糖珠偶联反应,清洗,洗脱,逆转交联及纯化DNA参照试剂盒推荐步骤。 1.2.4 CHIP-Real-timePCR及数据分析
测定免疫沉淀的DNA,选用SsoFast EvaGreen Supermix(Bio-Rad公司),其中包含Sso7d-fusion polymerase,dNTP,EvaGreen染料等。免疫沉淀的待测DNA上样量为 2 μL,每样本2次重复。靶序列引物α-satellite见1.1。反应条件:预变性98 ℃ 3 min,变性98 ℃ 10 s,退火延伸58 ℃ 30 s,36个循环。所得样本数据以本组input为参照进行标准化得出富集量,所有富集量均以本组IgG阴性对照相比得出相对富集倍数。实验均重复3次。 1.3 统计学方法
采用SPSS 17.0 统计软件,数据用x±s表示,进行成组t检验。 2 结果 2.1 H2AX磷酸化对DSB诱导剂的剂量时间依赖和恢复过程
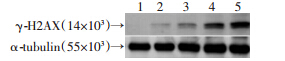
随着Ncs作用浓度的增加,γ-H2AX的生成逐渐增多(图 1)。随后,对Ncs作用不同时间后的细胞总蛋白提取物的检测发现,随着Ncs作用时间的增加,γ-H2AX的生成逐渐增多(图 2)。以0.5 μmol/L Ncs作用30 min或1 h后进行恢复过程的检测,发现0.5 μmol/L Ncs作用30 min的细胞恢复1 h后,γ-H2AX的生成达到最高水平,随后逐渐下降。然而在作用1 h的情况下,γ-H2AX在达峰后不能去磷酸化恢复(图 3)。
 |
| 1~5:Ncs处理剂量分别为0、0.05、0.1、0.5、1 μmol/L 图 1 γ-H2AX对Ncs的剂量依赖过程 |
 |
| 1~5:Ncs处理时间分别为0、5、15、30、60 min 图 2 γ-H2AX对Ncs的时间依赖过程 |
 |
| A:0.5 μmol/L Ncs处理30 min后恢复;B:0.5 μmol/L Ncs处理1 h后恢复 1:未处理对照;2~5:0、1、2、4 h 图 3 γ-H2AX脱磷酸化恢复过程 |
随着NU7026或Ku55933浓度的上升(0、20、40、80 μmol/L),DNA-PKcs磷酸化位点S2056和T2609的可检测信号逐渐降低。但NU7026并不影响T2609的磷酸化,Ku55933也不影响S2056的磷酸化(图 4)。在NU7026或Ku55933处理后,γ-H2AX的生成均明显下降,在NU7026作用组呈持续下降趋势,而在Ku55933处理组,γ-H2AX的生成高峰延迟到细胞恢复2 h后(图 5)。
 |
| A:不同浓度NU7026预处理2 h;B:不同浓度Ku55933预处理2 h 1~4分别为0、20、40、80 μmol/L 图 4 NU7026及Ku55933对DNA-Pkcs磷酸化的抑制 |
 |
| A:0.5 μmol/L Ncs+80 μmol/L NU7026;B:0.5 μmol/L Ncs+80 μmol/L Ku55933 1:未处理对照;2:Ncs处理后1 h;3:抑制剂+Ncs处理后1 h;4:Ncs处理后2 h;5:抑制剂+Ncs处理后2 h 图 5 NU7026及Ku55933对H2AX磷酸化的影响 |
在无损伤情况下,γ-H2AX相对富集量为1.12倍。而在Ncs作用后,γ-H2AX相对富集量为4.76倍,NU7026处理组为1.31倍,仅为NU7026未处理组富集量的27%(P<0.05)。在另一组独立实验中,Ncs作用后,γ-H2AX相对富集量是4.5倍,KU55933处理组为 2.82倍,为KU55933未处理组富集量的63%(P<0.05)。 3 讨论
DSB是对基因组完整性影响最大的一种DNA损伤形式,或导致细胞死亡,或导致基因变异,癌症发生。为了应对DSB,细胞内数以百计的DNA损伤反应蛋白被有组织、有顺序的募集到损伤部位,参与信号传导,启动修复途径,或启动细胞周期阻滞乃至诱导细胞凋亡。在所有损伤应答的早期事件中,组蛋白H2AX的Ser139位点迅速磷酸化(γ-H2AX)是信号传导的关键环节,H2AX缺陷小鼠细胞表现出强烈的基因组不稳定并且DNA修复蛋白募集障碍[6]。尽管对于H2AX的磷酸化机制已经有了大量研究,但近年来,H2AX的磷酸化是由ATM单独完成或由ATM和DNA-PKcs共同完成却成为一个有争议的观点。有报道称DNA-PKcs在H2AX磷酸化过程中占主导地位[5];在脾细胞中,γ-H2AX的生成主要受DNA-PK的调控[7]。我们的研究采用γ-H2AX染色质免疫共沉淀的方法,为这一有争议的观点补充定量数据。
neocarzinostatin是由载体蛋白及发色基团构成的高效的蛋白质抗生素家族DSB诱导剂,在nmol级别便发挥活性,100 ng/mL (约10 nmol/L) 浓度作用下便可观察到DNA修复蛋白染色质聚集的荧光信号[8]。并且在孵育数分钟内便可诱导DSB生成[9]。这与本文中Ncs处理后5 min内诱导γ-H2AX生成相符。为进一步观察Ncs的作用是否具有浓度及时间依赖性,我们进行了浓度梯度(0、0.05、0.1、0.5、1 μmol/L)及时间过程实验(0、5、15、30 min及1 h),结果显示Ncs作用细胞,诱导H2AX磷酸化呈现出浓度及时间依赖,提示要得到更多的γ-H2AX,需要采用较长的作用时间和较大的作用
浓度。Ncs作用后1 h内γ-H2AX达到峰值,这可能因其在损伤染色质周围延伸所致[10]; 随后缓慢去磷酸化,4 h后明显降低,但这取决于损伤的程度,即与Ncs的作用时间及作用浓度有关。在本研究中,大于1 h的作用时间后,γ-H2AX不能去磷酸化,这可能是因为过度的损伤超出细胞的修复能力,乃至细胞凋亡所致。因此,本研究最终选择0.5 μmol/L的Ncs作用30 min,细胞恢复1 h的状态来完成研究。
在HeLa细胞中,干扰DNA-PKcs表达会同时引起ATM的下调[11]。因此我们仅仅采用DNA-PKcs抑制剂而非其表达干扰的方式来进行研究。当DSB发生后,DNA-PKcs在其S2056位点发生自磷酸化,而其T2609位点被ATM磷酸化。采用DNA-PKcs特异性抑制剂NU7026,通过0~80 μmol/L的浓度梯度作用,DNA-PKcs自磷酸化位点S2056的磷酸化形式逐渐下降,然而T2609位点的磷酸化却不受影响。相应地,ATM的特异性抑制剂Ku55933处理后,T2609位点的磷酸化形式逐渐下降,而S2056的磷酸化不受影响。因此,选用80 μmol/L的作用浓度,可以有效的、特异的抑制DNA-PKcs或ATM。我们通过免疫印迹发现,NU7026明显抑制Ncs诱导的γ-H2AX生成。虽然KU55933也抑制γ-H2AX生成,但1 h以后γ-H2AX生成恢复,呈高峰延后的状况。这与有报道在ATM缺陷MEF细胞,2 Gay X射线诱导的γ-H2AX高峰出现延迟相似[3],可能因为ATM在DSB早期应答作用更为重要有关。至此,我们仍难以得出DNA-PKcs或ATM对磷酸化H2AX中谁起主导作用。因此,我们选用γ-H2AX染色质免疫共沉淀(CHIP)对H2AX在DSB的磷酸化状况进行分析。不同于限制性内切酶的作用,Ncs等化学诱导剂及射线所产生的DSB是随机的,因此在进行定位性研究时,我们必须选用DNA重复序列以增加探测到DSB的概率。α-satellite是171 bp 的中心粒序列,每个染色体包含多种α-satellite序列,不断重复并可延伸至5 Mbp长度,因此我们以此为靶目标来进行γ-H2AX CHIP研究。在未处理对照组,γ-H2AX富集量很低,与非特异性阴性对照IgG相当,即相对富集量接近于1。Ncs作用后,γ-H2AX相对富集量为4.76倍,同时施加NU7026处理后,γ-H2AX相对富集量仅为1.31倍,为NU7026未处理组富集量的27%(P<0.05),因此抑制DNA-PKcs后,γ-H2AX生成受抑73%,说明DNA-PKcs在磷酸化H2AX过程中发挥主导作用。 为进一步证明我们的结 论,我们进行了ATM抑制实验,Ncs作用后,γ-H2AX相对富集量为4.5倍,接近于之前的4.76倍。KU55933 处理组为2.82倍,为KU55933未处理组的63%(P<0.05),因此抑制ATM后,γ-H2AX生成受抑仅37%,远远低于抑制DNA-PKcs所带来的影响。
综上所述,本研究结果提示在DSB应答过程中,DNA-PKcs对H2AX磷酸化起主导作用。进一步显示出DNA-PKcs在DSB修复过程中的核心地位,为更详尽揭示DSB修复机制提供依据。
| [1] | Scully R, Xie A. Double strand break repair functions of histone H2AX[J]. Mutat Res, 2013, 750(1/2): 5-14. |
| [2] | Wang L, Dai W, Lu L. Osmotic Stress-induced Phosphorylation of H2AX by Polo-like-Kinase 3 Affects Cell Cycle Progression in Human Corneal Epithelial Cells[J]. J Biol Chem, 2014, 289(43): 29827- 29835. |
| [3] | Stiff T, O’Driscoll M, Rief N, et al. ATM and DNA-PK function redundantly to phosphorylate H2AX after exposure to ionizing radiation[J]. Cancer Res, 2004, 64(7): 2390-2396. |
| [4] | Di-Siena S, Campolo F, Rossi P, et al. UV and genotoxic stress induce ATR relocalization in mouse spermatocytes[J]. Int J Dev Biol, 2013, 57(2/4): 281-287. |
| [5] | An J, Huang Y C, Xu Q Z, et al. DNA-PKcs plays a dominant role in the regulation of H2AX phosphorylation in response to DNA damage and cell cycle progression[J]. BMC Mol Biol, 2010, 11: 18. |
| [6] | Bonner W M, Redon C E, Dickey J S, et al. GammaH2AX and cancer[J]. Nat Rev Cancer, 2008, 8(12): 957-967. |
| [7] | Koike M, Sugasawa J, Yasuda M, et al. Tissue-specific DNA-PK-dependent H2AX phosphorylation and gamma-H2AX elimination after X-irradiation in vivo[J]. Biochem Biophys Res Commun, 2008, 376(1): 52-55. |
| [8] | Nakada S, Yonamine R M, Matsuo K. RNF8 regulates assembly of RAD51 at DNA double-strand breaks in the absence of BRCA1 and 53BP1[J]. Cancer Res, 2012, 72(19): 4974-4983. |
| [9] | Akopiants K, Mohapatra S, Menon V, et al. Tracking the processing of damaged DNA double-strand break ends by ligation-mediated PCR: increased persistence of 3′-phosphoglycolate termini in SCAN1 cells[J]. Nucleic Acids Res, 2014, 42(5): 3125-2137. |
| [10] | Nakamura A J, Rao VA, Pommier Y, et al. The complexity of phosphorylated H2AX foci formation and DNA repair assembly at DNA double-strand breaks[J]. Cell Cycle, 2010, 9(2): 389-397. |
| [11] | Peng Y, Woods R G, Beamish H, et al. Deficiency in the catalytic subunit of DNA-dependent protein kinase causes down-regulation of ATM[J]. Cancer Res, 2005, 65(5): 1670-1677. |



