无精症患者占男性不育的10%~20%,其中包括梗阻性无精症(obstructive azoospermia,OA)和非梗阻性无精症(non-obstructive azoospermia,NOA)。前者可以通过经皮附睾精子抽吸术(percutaneous epididymal sperm aspiration,PESA)和经皮睾丸精子抽吸术(testicular sperm aspiration,TESA)得到精子,而后者因为精子库精子相对匮乏,生育问题未能得到很好的解决。随着显微取精和辅助生殖技术的进步,NOA患者有机会通过卵泡浆内单精子注射技术(intracytoplasmic sperm injection,ICSI)得到血亲子代,但受技术及设备等因素的制约,国内大多数生殖中心尚未开展显微取精和微量精子冷冻技术,况且显微取精需要切开睾丸,创伤较大,破坏其血供,容易形成瘢痕粘连,甚至睾丸萎缩,获精率偏低。如何把取精风险降低,又能使患者最大可能地获得可利用精子?这就需要对NOA患者生精能力给予更客观、科学的评估,对通过外科手术获得精子的概率进行预测。虽然该类手术较小,但是有创的操作,会对患者产生心理及生理上的影响。在临床工作中,能否利用NOA患者的睾丸体积和生殖激素水平等因素预测其睾丸内能否找到精子,以及可能性的大小,这对于该类患者是否需要外科手术取精,以及能否利用试管婴儿技术获得血亲后代十分重要,也可为NOA患者建立无创评估体系提供重要资料。本研究选择我院133例NOA患者的临床资料,分析睾丸大小与生殖激素水平等参数对TESA结果的预测价值,寻找能够通过外科手术发现精子的睾丸体积和生殖激素水平的切点值,以期为NOA患者是否需要接受外科手术治疗提供临床依据。 1 资料与方法 1.1 研究对象及分组
2013年1月至2014年1月在河南省人民医院生 殖中心男科门诊就诊的NOA患者133例,排除染色体为47,XXY的患者,年龄22~41岁,不育年限1~12年,根据世界卫生组织(WHO)《男子不育标准化检查与诊疗手册》[1],通过详细的病史采集、体格检查,采用Prader睾丸模型作比拟法测量睾丸体积,记录其大小。按照WHO《人类精液及精子-宫颈黏液相互作用实验室检验手册》[2],经连续3次以上精液离心后进行沉淀镜检未发现精子,结合精浆果糖、中性ɑ糖苷酶及B超结果排除梗阻性因素。根据睾丸穿刺结果分为无精子组和有精子组。无精子组100例,有精子组33例。所有研究对象签署知情同意书,本研究获医院伦理委员会批准。 1.2 睾丸穿刺的方法
所有患者完善术前检查,由本中心同一位男科医师完成手术过程。取平卧位,常规消毒铺巾,左手拇指、食指、中指固定较大一侧睾丸,1%的利多卡因局部浸润麻醉,专用的带侧孔的睾丸穿刺针(一次性无菌溶药20 mL注射器)沿前者的针孔进入睾丸组织,左手挤压睾丸组织,右手负压抽吸组织。若一次获取组织较少,可反复穿刺,将取出的睾丸组织分成2份,1份针刺破碎后在400倍的倒置显微镜下仔细寻找精子,另1份置于Bouins固定液中送病理检查。两份睾丸组织只要发现精子即认为是有精子,否则为无精子。术后局部消毒,纱布固定包扎。 1.3 生殖激素测定方法
清晨8:00-10:00空腹抽取静脉血,分离血清后,分别测定促卵泡生成素(follicle stimulating hormone,FSH),黄体生成素(luteinizing hormone,LH),总睾酮(total testosterone,TT),催乳素(prolactin,PRL),雌激素(estrogen,E2),并计算总睾酮/黄体生成素(T/LH)、总睾酮/雌激素(T/E2)。德国罗氏公司Elecsys-2010全自动电化学发光免疫分析仪检测,试剂、标准品均由Roche Diagnostics GmbH公司提供。试剂批内和批间变异系数分别<3.0%。 1.4 AZF基因微缺失检测方法
序列标签(STS)位点根据欧洲男科学协会(EAA)和欧洲分子遗传实验质控协作网(EMQN)推荐的标准 设计,分别为AZFa区的sY84(326 bp)和sY86(320 bp)、 AZFb区的sY127(274 bp)和sY134(301 bp)、AZFc区的sY254(400 bp)和sY255(126 bp),由Invitrogen公司合成。每个样品分为A、B组进行多重PCR实验,A组包括sY254、sY86、sY127,B组包括sY84、sY134、sY255。PCR反应总体系为10 μL,包括去离子水、缓冲液、dNTP、DNA聚合酶及模板。PCR扩增条件:95 ℃预变性15 min,95 ℃变性30 s,57 ℃退火60 s,72 ℃延伸60 s,共35个循环,72 ℃延伸10 min,最后4 ℃保温。取PCR扩增产物5 μL,加1 μL 6×上样缓冲液,在3.0%的琼脂糖凝胶上电泳,100 V电压电泳45 min,紫外灯下观察分析。 1.5 统计学分析
采用SPSS 17.0统计软件,数据用x±s表示,2组数据间的差异比较采用非参数检验。通过Logistic回归分析,筛选出与患者行睾丸穿刺活检发现精子相关程度较高的指标为FSH(χ2=29.468,P<0.01)。应用受试者工作特征曲线(receiver operating curve,ROC)对NOA患者睾丸体积、FSH等数值进行优选,寻找最佳切点值,绘制ROC曲线,计算ROC曲线下的面积(area under the curve,AUC)来判断监测方法的优劣。 2 结果 2.1 睾丸体积和生殖激素水平
研究对象的年龄、睾丸体积和生殖激素水平等参数统计学比较结果见表 1。2组之间FSH、睾丸体积、TT、T/LH和T/E2差异都具有统计学意义,FSH尤为显著(P<0.01)。我院生殖中心男科实验室生殖激素的正常参考范围,FSH:1.5~12.4 mIU/mL,LH:1.7~ 8.6 mIU/mL,PRL:4.04~15.2 ng/mL,TT:2.8~8 ng/mL,E2:7.63~42.6 pg/mL。
| 组别 | n | 年龄(岁) | 左睾丸(mL) | 右睾丸(mL) | FSH(mIU/mL) | LH(mIU/mL) | PRL(ng/mL) | TT(ng/mL) | E2(pg/mL) | T/LH | T/E2 |
| 有精子组 | 33 | 28.27±3.56 | 9.12±2.25 | 9.23±2.02 | 9.82±2.09 | 8.56±1.77 | 16.23±4.14 | 5.19±0.68 | 31.29±4.90 | 0.61±0.19 | 162.40±16.66 |
| 无精子组 | 100 | 28.63±4.44 | 6.25±2.63 | 6.47±2.48 | 22.62±15.00 | 9.30±6.12 | 16.43±9.06 | 4.15±1.82 | 32.87±13.19 | 0.57±0.35 | 141.40±93.40 |
| P值 | 0.632 | 0.001 | 0.001 | <0.01 | 0.403 | 0.882 | <0.01 | 0.409 | 0.002 | 0.003 |
采用Logistic回归分析检验发现:FSH对预测NOA患者睾丸内是否存在精子的拟合优度最佳(Wald χ2=23.592,P<0.01),其次为睾丸体积(χ2=21.173,P<0.01),再者为T/LH(Wald χ2=20.413,P<0.01),其他参数在回归分析模型中拟合度不佳。 2.3 利用ROC曲线优选生殖激素水平的切点值
假设以睾丸穿刺结果为“金标准”,优选睾丸体积和生殖激素水平预测穿刺结果的切点值。以睾丸穿刺结果为状态 变量,分别以睾丸体积和生殖激素水平及相 关参数为检验变量建立ROC曲线(图 1)。利用ROC曲线分析各个数值切点的敏感性和特异性。当FSH的切点值为13.31 mIU/mL时,其敏感度为74.1%,特异性为96.2%。睾丸体积切点值为8.5 mL,其敏感度 为68%,特异性为93.8,提示睾丸体积对NOA患者诊断预测能力中等。另外,LH、PRL、T、T/LH、T/E2 AUC分别为0.470、0.429、0.657、0.637、0.669。
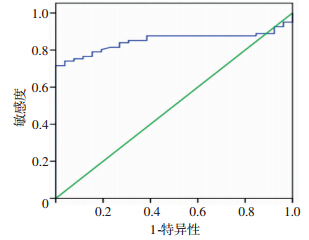 |
| 图 1 促卵泡生成素ROC曲线的切点值(AUC=0.850) |
无精子症组AZF缺失患者高于有精子症组,其中联合缺失高达7%。有精子组AZF基因微缺失多集中在c区(表 2)。
| 组别 | n | AZFc | AZFa | AZFa+b | AZFb+c |
| 有精子组 | 33 | 9.09(3/33) | 3.03(1/33) | 0(0/33) | 3.03(1/33) |
| 无精子组 | 100 | 0(0/100) | 4(4/100) | 3(3/100) | 4(4/100) |
精子的发生是一个复杂的过程,其中涉及有丝分裂和减数分裂,并且还有40多种酶的参与。这一过程发生在睾丸内部,通过血睾屏障和人体的免疫系统隔离,有其相对的独立性。非梗阻性无精症是一种最严重的精子发生障碍,目前对它的评估和治疗还是一种严峻的挑战。虽然对它的诊断有一套完整的方案,但是对非梗阻性无精症患者来说在临床中通过药物治疗和外科手术找到精子的机会还是很小。对这类患者来说,不管是传统的TESA还是睾丸切开显微取精术(micro-TESE),都有创伤,会给患者造成一定 的生理和心理上的影响,尤其是术后未发现精子的时候。为了避免给患者带来不必要的创伤,如何从临床和实验室指标来预测精子的发生及发生的可能性,仍需深入研究。
下丘脑-垂体-睾丸性腺轴对精子的发生起着重要的调控作用。下丘脑分泌GnRH,GnRH激活垂体前叶的腺苷酸环化酶,刺激垂体前叶分泌FSH和LH。FSH主要作用于精子成熟的最后阶段,促进次级精母细胞发育为精子细胞和精子,刺激支持细胞发育,并促进其产生一种能结合雄激素的蛋白质,通过这种蛋白质,使生殖细胞获得稳定高浓度的雄激素,促进生殖细胞发育分化为成熟的精子。精子的发生和维持,需要垂体分泌的FSH和睾丸间质细胞分泌的睾酮的协同作用。多数学者都在关注FSH与非梗阻性无精症的相关性研究,寻找促使精子发生的相关因素,试图建立非梗阻性无精症的无创伤评估体系。对非梗阻性无精子症的诊断,睾丸组织的穿刺病理检查结果仍是重要的一环。国外有文章报道针对非梗阻性无精症患者采用micro-TESE获取精子的概率达到了50.3%[3]。随着国内外显微取精技术的发展,越来越多的非梗阻性无精症患者会愿意接受显微手术治疗,进而通过微量精子冷冻和单精子卵细胞浆内注射技术获取后代,但是目前国内仍有部分生殖中心因人员、设备及技术等因素尚未开展显微取精技术和微量精子冷冻技术。本研究主要利用生殖激素水平和睾丸体积及相关参数来预测精子存在的可能性,避免非梗阻性无精症患者接受不必要的外科手术治疗,节约有限的医疗资源,减轻患者经济及精神上的压力。
Ramasamy等[4]通过睾丸切开显微取精术研究792例非梗阻性无精症患者,按FSH水平将患者分为4组: <15 IU/mL、15≤FSH<30 IU/mL、30≤FSH<45 IU/mL、≥45 IU/mL,比较发现FSH<15 IU/mL组的患者获取成熟精子的机会显著大于FSH≥15 IU/mL组。Chen等[5]通过对208例非梗阻性无精症患者行FSH检验和TESA手术进行了一项前瞻性研究,按照TESA是否找到成熟精子分为两组,寻找FSH的切点值为19.4 mIU/mL,等于或高于此值的患者没有发现精子。本研究发现在各个参数中FSH对预测非梗阻性无精症患者睾丸内是否存在精子价值最大,通过 ROC曲线分析其切点值为13.31 mIU/mL,大于此值即认为睾丸内无可利用精子,小于此值认为睾丸内能发现可利用精子,其敏感度为74.1%,特异性为96.2%。
根据以往的临床经验和文献显示睾丸的体积大小跟睾丸的生精功能是呈正相关的,在无精子症患者中睾丸体积<6 mL就认为精子发生的可能性非常小。Golpi等[6]研究发现当睾丸体积≥12 mL时,在非梗阻性无精症患者发现精子的机会为61.11%,当8 mL≤睾丸体积<12 mL时,机会为48.21%,当睾丸体积<8 mL时,机会为42.19%。同时他认为睾丸体积对于预测精子是否存在是个有意义的参数。有学者认为睾丸体积比FSH对非梗阻性无精子症患者睾丸内精子发生的预测价值更大[7],但本研究发现睾丸体积对预测精子是否存在的价值低于FSH。随着生精功能障碍程度的加重,睾丸体积的缩小趋势就越明显[8],从本研究的ROC曲线结果看,当非梗患者的睾丸体积>8.5 mL时,找到精子的可能性较大,反之较小。它的预测价值低于FSH,但明显优于其他参数。这一研究结果与王雨新等[9]的研究一致。但是比Golpi等[6]研究的能发现精子的睾丸体积偏高,考虑可能是手术取精的方式不同,前者手术取精方式更为精细。从FSH和睾丸体积对精子存在的预测价值看,作者认为两者的联合应用对非梗患者将更有意义。
在睾丸内部,促黄体生成素作用于间质细胞的黄体生成素受体,使其分泌睾酮,睾酮反过来也会抑制LH的分泌。睾酮和雄烯二酮经过芳香化酶的作用转 化为雌酮和雌二醇,两者之间的平衡以及平衡的持续将有益于精子的发生。Cavallini等[10]研究来曲唑在非梗患者中的作用,发现T/E2<10的患者服用后精子的数量明显增多,可能是受益于T/E2趋于更合理的比例。
本研究结果显示染色体异常和生精因子的微缺失可以作为一个独立的预测睾丸内是否存在精子的参数。Ambulkar等[11]研究发现在印度中部地区Y染色体微缺失在重度少弱精子症和无精子症患者中占有8.33%,其中AZFc缺失高达84.6%。Dabaja 等[12]发现AZFc缺失的患者通过显微镜下睾丸切开发现精子的机会为72%,而AZFa、AZFb缺失的患者却没有找到精子。郑菊芬等[8]研究发现AZF基因微缺失概率与生精障碍程度无高度相关性,但是NOA患者中AZF基因微缺失概率达到15%以上,AZF基因微缺失可能是NOA患者的主要遗传原因。本研究中无精子组AZF缺失患者明显高于有精子组,无精子组AZF的联合缺失达到7%。提示在临床工作中,一旦发现AZF的联合缺失,最好不行外科手术寻找精子。
| [1] | Rowe P J, Comhaire F H, Hargreave T B, 等.世界卫生组织男性不育标准化检查与诊疗手册[M].李铮, 张忠平, 黄冀然, 等. 译.北京: 人民卫生出版社, 2007: 43-44. |
| [2] | 国家人口和计划生育委员会科学技术研究所、中华医学会男科学分会、中华医学会生殖医学分会精子库管理学组. 世界卫生组织人类精液检查与处理实验室手册[M].5 版. 北京: 人民卫生出版社, 2011: 35-36. |
| [3] | Esteves S C. Microdissection testicular sperm extraction (micro-TESE) as a sperm acquisition method for men with nonobstructive azoospermia seeking fertility: operative and laboratory aspects[J].Int Braz J Urol, 2013, 39(3): 440-441. |
| [4] | Ramasamy R, Lin K, Gosden L V, et al. High serum FSH levels in men with nonobstructive azoospermia does not affect success of microdissection testicular sperm extraction[J]. Fertil Steril, 2009, 92(2): 590-593. |
| [5] | Chen S C, Hsieh J T, Yu H J, et al. Appropriate cut-off value for follicle-stimulating hormone in azoospermia to predict spermatogenesis[J]. Reprod Biol Endocrinol, 2010, 8: 108. |
| [6] | Colpi G M, Colpi E M, Piediferro G, et al. Microsurgical TESE versus conventional TESE for ICSI in non-obstructive azoospermia: a randomized controlled study[J]. Reprod Biomed Online, 2009, 18(3): 315-319. |
| [7] | 唐文豪, 姜辉, 马潞林, 等. 非梗阻性无精子症患者睾丸体积、生殖激素水平与睾丸穿刺取精结果的相关性研究[J]. 中华男科学杂志, 2012, 18(1): 48-51. |
| [8] | 郑菊芬, 施长根.陈小豹, 等. 非梗阻性无精子症和隐匿精子症与睾丸体积、血FSH和AZF基因微缺失的相关性分析[J]. 生殖与避孕, 2013, 33(12): 811-815. |
| [9] | 王雨新, 刘晓红, 焦永凤. 无精子症患者血清中FSH的测定及临床意义[J]. 中国优生与遗传杂志, 2009, 17(7): 114-115, 131. |
| [10] | Cavallini G, Biagiotti G, Bolzon E. Multivariate analysis to predict letrozole efficacy in improving sperm count of non-obstructive azoospermic and cryptozoospermic patients: a pilot study[J]. Asian J Androl, 2013, 15(6): 806-811. |
| [11] | Ambulkar P S, Sigh R, Reddy M, et al. Genetic Risk of Azoospermia Factor (AZF) Microdeletions in Idiopathic Cases of Azoospermia and Oligozoospermia in Central Indian Population[J]. J Clin Diagn Res, 2014, 8(3): 88-91. |
| [12] | Dabaja A A, Schlegel P N. Microdissection testicular sperm extraction: an update[J].Asian J Androl, 2013, 15(1): 35-39. |



