骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一种具有很强自我更新能力和多向分化潜能的干细胞,在一定的诱导条件下,其可向成骨、成肌、成脂等多种细胞分化[1, 2],因此,在再生医学领域,MSCs一直被作为理想种子细胞用于多种组织的修复[3],也被用于骨质疏松、难治性骨折等骨科疾病治疗的研究。本课题组构建的永生化小鼠胚胎成纤维细胞(immortalized mouse embryonic fibroblasts,iMEF)具备MSCs特征,可用于体内外MSCs相关实验中[4]。BMP9在体外可以诱导MSCs向成骨分化,是目前已经分离并鉴定的20余种BMPs中诱导MSCs成骨分化能力最强的因子[5, 6],但具体机制不清楚。Notch1是Notch信号通路受体之一,有研究表明其在MSCs成骨分化中发挥重要作用[7, 8, 9, 10]。那么在BMP9诱导的MSCs成骨分化过程中,Notch1扮演什么样的角色呢?本研究探讨Notch1在BMP9诱导的iMEF细胞成骨分化中的作用,以期对MSCs成骨分化的研究提供更可靠的依据。 1 材料与方法 1.1 材料 1.1.1 细胞株及腺病毒
永生化小鼠胚胎成纤维细胞(immortalized mouse embryonic fibroblasts,iMEF)、dnNotch 1、红色荧光蛋白(red fluorescent protein,RFP)、骨形态发生蛋白9(bone morphogenetic protein 9,BMP9)、绿色荧光蛋白(green fluorescence protein,GFP)均由芝加哥大学何通川惠赠并由本实验室保存、人结肠癌细胞株HCT116由重庆医科大学分子实验室保存。 1.1.2 主要试剂
DMEM及MEM高糖培养基(Hyclone公司),胎牛血清(Gibco公司),小牛血清(Hyclone公司),磷酸盐粉(中杉金桥公司),RNA提取试剂Trizol(Invitrogen 公司),ALP染色试剂(Sigma公司),荧光素酶检测试剂(Promega 公司),SYBR GreenⅠ试剂(TaKaRa公司),引物(Invitrogen公司合成),Western及IP细胞裂解液(碧云天公司),牛血清粉BSA(Sigma 公司),p-Smad1/5/8抗体(CST公司),Smad1/5/8抗体和β-actin单抗隆抗体(Santa Cruz 公司),羊抗鼠、羊抗兔抗体(中杉金桥公司)。 1.2 方法 1.2.1 细胞培养与处理
复苏iMEF细胞培养于含10%胎牛血清、1%青霉素/链霉素(P/S)、DMEM高糖培养基中。HCT116细胞培养于含10%小牛血清、1%(P/S),MEM/EBSS高糖培养基中。37 ℃、5% CO2条件下培养。待细胞贴壁生长并融合至80%左右时,用适量胰蛋白酶进行消化传代。 1.2.2 ALP活性测定与染色
将iMEF细胞接种至24孔板,按2×104/孔,待细胞融合至30%左右时,加入RFP或dnNotch1后换液,待红色荧光出现后(约36 h),加入适当量的条件培养基,继续培养5 ~7 d进行ALP染色与ALP活性定量分析。ALP染色:吸引器 吸去培养基,每孔200~500 μL ALP染色液,避光,10~30 min后观察染色。ALP活性定量分析:吸引器吸去培养基,加入1×细胞裂解液100 μL /孔,静置5 min。 刮下细胞裂解物并收集至EP管,离心(13 000 r/min,5 min)。另一EP管中加入ALP底物与Lupo Buffer混合液(1 ∶3)20 μL。吸取5 μL裂解上清至上述EP管内,混匀,避光静置45~60 min后上机检测。 1.2.3 SBE荧光素酶检测
将iMEF细胞接种至T25中,待细胞融合至50%左右时,利用脂质体2000将SBE质粒转染入细胞内,37 ℃、5%CO2培养过夜,铺24孔板,同时加入dnNotch1和BMP9,感染率均约50%,8 h后换液,36 h后检测SBE荧光素酶活性。 1.2.4 PCR检测
培养iMEF至一定时间收集细胞,用TRIzol试剂提取细胞总RNA,通过琼脂电泳验证mRNA的质量并进行定量,取1 μg RNA逆转录为cDNA,并将cDNA置于-20 ℃保存以普通PCR和实时荧光定量PCR备用。RT-PCR:20μL体系,反应条件,95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,26~30个循环;72 ℃ 10 min。2%琼脂糖凝胶跑电泳,凝胶成像,引物见表 1。qRT-PCR:10 μL体系,反应条件,预变性94 ℃ 2 min; 92 ℃ 20 s;68 ℃ 30 s; 72 ℃ 20 s,延伸末尾采集荧光,40个循环;融解曲线荧光采集(65~99 ℃)。
| 引物 | 引物序列 | 产物长度(bp) |
| Notch1 | 上游 5′-CCTGCCACTATGGTTCCTGT-3′下游 5′-CCCTTGAGGCATAAGCAGAG-3′ | 175 |
| Notch2 | 上游 5′-CCTGAACGGGCAGTACATTT-3′下游 5′-GCGTAGCCCTTCAGACACTC-3′ | 165 |
| Notch3 | 上游 5′-CTCAACTCCAGGCTCACCTC-3′下游 5′-GGCTGAGCCAAGAGAACAAC-3′ | 165 |
| Notch4 | 上游 5′-AATGGGGGTACCTGTGTGAA-3′下游 5′-GTATAGCCAGGGCTGCAGAG-3′ | 179 |
| dnRNotch1 | 上游 5′-GCAGAACAACAAGGAGGAGACT-3′下游 5′-GAGGTCCTTAGCTTCCTTGCTAC-3′ | 361 |
| Hey 1 | 上游 5′-GGCCTGCTTGGCTTTTCT-3′下游 5′-CCAAGTGCAGGCAAGGTC-3′ | 120 |
| OPN | 上游 5′-ACACTTTCACTCCAATCGTCC-3′下游 5′-TGCCCTTTCCGTTGTTGTCC-3′ | 240 |
| OCN | 上游 5′-TCTGACAAAGCCTTCATGTCC-3′下游 5′-AAATAGTGATACCGTAGATGG-3′ | 199 |
| Runx2 | 上游 5′-GGTGAAACTCTTGCCTCGTC-3′下游 5′-AGTCCCAACTTCCTGTGCT-3′ | 243 |
| CollaⅠ | 上游 5′-CGGCTCCTGCTCCTCTTA-3′下游 5′-TTCATTGCATTGCACGTCAT-3′ | 183 |
| Id 1 | 上游 5′-ACGACATGAACGGCTGCT-3′下游 5′-CAGCTGCAGGTCCCTGAT-3′ | 122 |
| Id 2 | 上游 5′-CAGCATCCCCCAGAACAA-3′下游 5′-TCTGGTGATGCAGGCTGA-3′ | 122 |
| Id 3 | 上游 5′-CTACGAGCGGTGTGCTG-3′下游 5′-GCGCGAGTAGCAGTGGTT-3′ | 120 |
| GAPDH | 上游 5′-GGCTGCCCAGAACATCAT-3′下游 5′-ATGATGTTCTGGGCAGCC-3′ | 180 |
细胞培养待汇合至50%左右时,加入RFP和dnNotch1,感染36 h后加入GFP或BMP9条件培养基,诱导培养3 d后行结晶紫染色,吸去24孔板内培养基,PBS洗2~3遍,加入10%甲醇(400 μL/孔),固定5 min,加入0.05%结晶紫溶液(400 μL/孔),染色2~5 min后观察染色情况,吸去染色液终止反应,加入ddH2O洗1遍,扫描成像。 1.2.6 Western blot检测
iMEF细胞培养待细胞融合至70%左右时加入dnNotch或RFP,病毒持续感染36 h后加入BMP9条件培养基,诱导1 h后提取总蛋白。用冰PBS洗涤细胞3次,并将残余液体吸净,加0.2 mL细胞裂解液,置于冰上 5 min;用橡皮刮刮下细胞,移入离心管;4 ℃ 13 000 r/min 离心20 min,取上清至另一个EP管中,并加入50 μL的5×蛋白上样缓冲液,最后沸水浴5~10 min,分装后-20℃保存备用。配制浓缩胶和分离胶,100 V恒压电压下SDS-PAGE凝胶电泳,200 mA恒流电流转膜,依次加一抗和二抗孵育、洗膜,化学法发光底物进行显影。 1.2.7 流式细胞仪检测细胞周期、细胞凋亡
细胞周期检测:吸去培养基,用胰酶将细胞消化下来,用冰1×PBS洗涤细胞3次,离心沉淀细胞,弃上清,用70%预冷的乙醇重悬,4 ℃存储过夜,上机检测。细胞凋亡检测:吸去培养基,用胰酶将细胞消化下来,用冰 1×PBS洗涤细胞3次,离心沉淀细胞,弃上清,上机检测。 1.3 统计学分析
采用SPSS 17.0统计软件,实验独立重复3次,数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用t检验,检验水准α=0.05。 2 结果 2.1 dnNotch1能够竞争抑制Notch1信号通路
采用qRT-PCR检测iMEF内Notch受体内源性表达情况,结果显示:Notch各受体表达并不一致,其中Notch1在4种Notch受体中表达最多,而Notch4几乎不表达(图 1)。用dnNotch1/RFP感染iMEF细胞,培养48 h后RT-PCR检测dnNotch1,结果显示:dnNotch1作用下,dnNotch1表达显著增加(图 2、3);qRT-PCR检 测Notch信号通路靶基因Hey1,结果显示:处理组Hey 1的 表达较空白对照组显著下调(0.75±0.08 vs 1.40±0.23,P<0.05)。
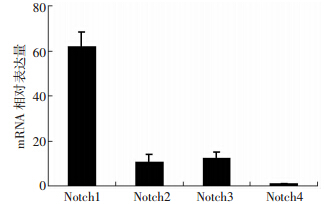 |
| 图 1 qRT-PCR检测iMEF细胞内源性Notch 受体表达 |
 |
| 图 2 腺病毒RFP和dnNotch1的感染效率(×100) |
 |
| 1:空白对照;2:RFP;3:dnNotch1 图 3 RT-PCR检测腺病毒dnNotch1处理后iMEF细胞内 Notch1(胞外段)的表达 |
用腺病毒RFP或dnNotch1感染iMEF细胞,感染效率约50%,待红色荧光表达后加入GFP或BMP9条件培养基,诱导分化3、5、7 d后检测ALP活性及染色变化。结果显示:dnNotch1能降低BMP9诱导的早期成骨指标ALP活性(图 4),且呈剂量依赖性(图 5);同时降低晚期成骨指标OCN、OPN的表达(图 6)。
 |
|
a:P<0.05 1:空白对照; 2:RFP;3:dnNotch1;4:BMP9; 5:BMP9+RFP; 6:BMP9+dnNotch1;a:P<0.05,与BMP9+dnNotch1比较 图 4 各组3、5、7 d ALP染色观察(A)及活性分析(B) |
 |
|
A:空白对照; B:dnNotch1;C:BMP9; D:BMP9+dnNotch1(L);E: BMP9+dnNotch1(M);F: BMP9+dnNotch1(H) dnNotch1 低(L)、中(M)、高(H)滴度分别为0.1、0.5、1.0 μL;A~F:ALP 染色(×100);G:ALP活性分析 1~6:分别为空白对照、dnNotch1、BMP9、BMP9+dnNotch1(L)、 BMP9+dnNotch1(M)、BMP9+dnNotch1(H);a: P<0.05,与BMP9比较 图 5 不同滴度dnNotch1处理后第5天ALP 染色活性检测 |
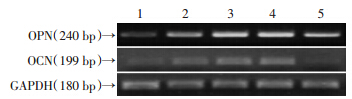 |
| 1:空白对照; 2:dnNotch1; 3:BMP9; 4:BMP9+RFP; 5:BMP9+dnNotch1 图 6 RT-PCR检测各组细胞处理后第9天OPN和 OCN表达 |
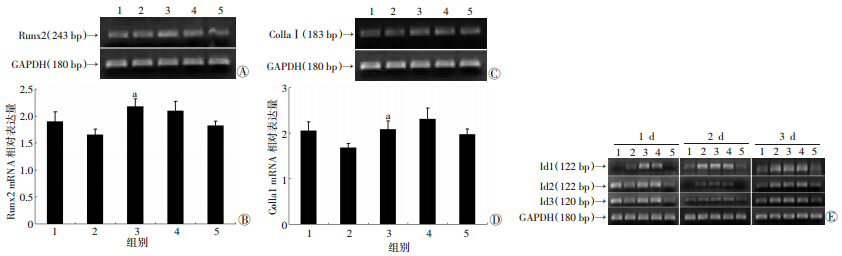
Western blot检测结果显示:BMP9能够上调p-Smad1/5/8 的蛋白水平,加入dnNotch1后,抑制了BMP9诱导的p-Smad1/5/8的蛋白水平(图 7)。同时,BMP9能够增加SBE荧光素酶活性,加入dnNotch1后,抑制了BMP9诱导的SBE荧光素酶活性(图 8)。上述结果提示:阻断Notch1信号通路后可一定程度上削弱BMP9对BMP信号的激活作用。同时,PT-PCR结果发现,BMP9能够上调Runx2和Id1成骨相关靶基因,而dnNotch1抑制了这一上调作用,但对Id2和Id3影响并不明显(图 9)。
 |
| 1:空白对照; 2:BMP9+dnNotch1; 3:BMP9+RFP; 4:BMP9; 5:dnNotch1 图 7 Western blot检测不同处理组BMP通路smad1/5/8改变 |
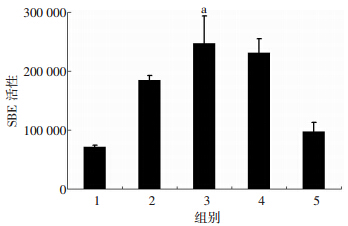 |
| 1:空白对照; 2:BMP9+dnNotch1; 3:BMP9+RFP; 4:BMP9; 5:dnNotch1;a:P<0.05,与BMP9+dnNotch1比较 图 8 荧光素酶检测不同处理组SBE活性改变 |
 |
|
1:空白对照; 2:BMP9+dnNotch1; 3:BMP9+RFP; 4:BMP9; 5:dnNotch1;a:P<0.05,与BMP9+dnNotch1比较 A、B :Runx2基因;C、D:Colla Ⅰ基因;E:Id1、2、3基因 图 9 不同处理组Runx2基因、Colla Ⅰ基因和Id1、2、3基因表达 |
结晶紫染色结果显示,诱导培养3 d后,BMP9+RFP 组细胞总数多于 BMP9+dnNotch1组,说明dnNotch1一 定程度上能够抑制了BMP9诱导的促iMEF细胞增殖作用(图 10)。流式细胞仪检测dnNotch1对BMP9作用下MEF细胞周期(图 11)及凋亡(图 12),结果显示:GFP+dnNotch1组、GFP+RFP组、BMP9+dnNotch1组、BMP9+RFP组的增殖指数(S+G2)分别为47.86%、48.32%、55.31%、66.82%,提示BMP9在早期具有一定的促MSCs增殖的作用,而dnNotch1可以抑制该作用,结晶紫染色得到相似结果;另一方面,dnNotch1对BMP9作用下的细胞凋亡并没有显著影响。
 |
| 图 10 结晶紫染色观察不同处理对iMEF增殖的影响 |
 |
| A: GFP+dnNotch1; B: GFP+RFP; C: BMP9+dnNotch1; D: BMP9+RFP 图 11 流式细胞仪检测不同处理对iMEF周期的影响 |
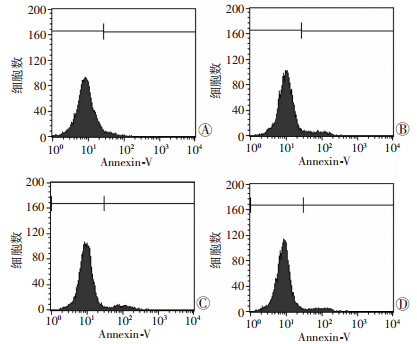 |
| A: GFP+dnNotch1; B: GFP+RFP; C: BMP9+dnNotch1; D: BMP9+RFP 图 12 流式细胞仪检测不同处理对iMEF凋亡的影响 |
MSCs是一种来源于骨髓基质具有自我更新和多向分化潜能的成体干细胞。因其具有取材方便,易于分离培养等优点,在细胞替代治疗、基因治疗以及组织器官再造中具有重要的临床应用价值[11, 12]。Notch信号是细胞与细胞之间直接作用的主要信号通路之一,与多种肿瘤的发生、发展密切相关,对多种细胞命运起决定性作用[13]。Notch1是Notch受体之一,属于Ⅰ型跨膜蛋白,由胞内区、跨膜区和胞外区组成[14]。研究发现,Notch1在MSCs的多向分化中发挥重要作用[15];Hiltion等[16]研究表明显示Notch1有抑制MSCs成骨分化的作用;而Jung等[17]发现蚕丝蛋白通过抑制Notch1和其下游靶基因的表达促进MSCs成骨分化,从而促进骨折愈合;Xu等[8]证明,在缺氧的状态下,MSCs内Notch信号通路活性和Notch1表达水平增加,但MSCs的成骨分化能力减弱,而抑制Notch1的活性可以恢复缺氧条件下MSCs向成骨分化的潜能。
本课题在证实dnNotch1能竞争性抑制iMEF细胞内源性Notch1表达,降低Notch信号通路活性的基础上,进一步发现dnNotch1能导致BMP9诱导iMEF早晚期成骨分化能力减弱,提示Notch1具有促进BMP9诱导MSCs成骨分化作用,与我们前期研究[18]结果相一致;但与文献[16, 17, 18, 19]提出Notch1抑制MSCs成骨分化观点不一致。导致造成此种差异的原因可能有:①研究所用细胞系的不同、同一细胞系分化阶段和动物背景的不同;②诱导MSCs成骨分化条件不同,有的是用BMP2诱导,而本实验是用BMP9诱导;③使用的载体系统不同,有的是逆转录病毒,有的是腺病毒;④构建载体所用启动子变异,有研究发现,当NICD cDNA置于长度是2.3 kb的CollaⅠ启动子时,转基因鼠呈现高骨量的表型[20];而当NICD cDNA置于长度是3.6 kb的CollaⅠ启动子时,转基因鼠呈现低骨量的表型,而患上骨质疏松症[21];⑤体内外环境的差异,体内环境较体外环境更复杂,除Notch1信号外,还有其他多种信号通路和分子参与MSCs向成骨分化的调控,如BMP、Wnt、Hedgehog和MAPK等信号通路[22],而且多条信号通路间存在交互串话,共同调节着MSCs的成骨分化。
综上所述,本研究证实dnNotch1抑制BMP9诱导iMEF向成骨分化,支持Notch信号通路促进BMP9诱导MSCs成骨分化的观点,但Notch1信号通路乃至整个Notch在不同情况下参与MSCs成骨分化的具体机制还需要进一步研究。
| [1] | Greenbaum A, Hsu Y M, Day R B, et al. CXCL12 in early mesenchymal progenitors is required for haematopoietic stem-cell maintenance[J]. Nature, 2013, 495(7440): 227-230. |
| [2] | Yang X, Du J, Xu X, et al. IFN-γ-secreting-mesenchymal stem cells exert an antitumor effect in vivo via the TRAIL pathway[J]. J Immunol Res, 2014, 2014: 318098. |
| [3] | Nelson F R, Brighton C T, Ryaby J, et al. Use of physical forces in bone healing[J]. J Am Acad Orthop Surg, 2003, 11(5): 344-354. |
| [4] | Huang E, Bi Y, Jiang W, et al. Conditionally immortalized mouse embryonic fibroblasts retain proliferative activity without compromising multipotent differentiation potential[J]. PLoS One, 2012, 7(2):e32428. |
| [5] | Kang Q, Song W X, Luo Q, et al. A comprehensive analysis of the dual roles of BMPs in regulating adipogenic and osteogenic differentiation of mesenchymal progenitor cells[J]. Stem Cells Dev, 2009, 18(4): 545-559. |
| [6] | He T C. Distinct osteogenic activity of BMPs and their orthopaedic applications[J]. J Musculoskelet Neuronal Interact, 2005, 5(4): 363-366. |
| [7] | Wharton K A, Yedvobnick B, Finnerty V G, et al. opa: a novel family of transcribed repeats shared by the Notch locus and other developmentally regulated loci in D. melanogaster[J]. Cell, 1985, 40(1): 55-62. |
| [8] | Xu N, Liu H, Qu F, et al. Hypoxia inhibits the differentiation of mesenchymal stem cells into osteoblasts by activation of Notch signaling[J]. Exp Mol Pathol, 2013, 94(1): 33-39. |
| [9] | Zanotti S, Canalis E. Notch and the skeleton[J]. Mol Cell Biol, 2010, 30(4): 886-896. |
| [10] | Tu X, Chen J, Lim J, et al. Physiological notch signaling maintains bone homeostasis via RBPjk and Hey upstream of NFATc1[J]. PLoS Genet, 2012, 8(3): e1002577. |
| [11] | Loebel C, Czekanska E M, Bruderer M, et al. In vitro osteogenic potential of human mesenchymal stem cells is predicted by Runx2/Sox9 ratio[J]. Tissue Eng Part A, 2014, [Epub ahead of print]. |
| [12] | Inomata K, Aoto T, Binh N T, et al. Genotoxic stress abrogates renewal of melanocyte stem cells by triggering their differentiation[J]. Cell, 2009,137(6): 1088-1099. |
| [13] | Tan T, Lu B, Zhang J, et al. Notch1 signaling antagonizes transforming growth factor-β pathway and induces apoptosis in rabbit trophoblast stem cells[J]. Stem Cells Dev, 2014, 23(8): 813-822. |
| [14] | Artavanis-Tsakonas S, Rand M D, Lake R J. Notch signaling: cell fate control and signal integration in development[J]. Science, 1999, 284(5415): 770-776. |
| [15] | Boopathy A V, Pendergrass K D, Che P L, et al. Oxidative stress-induced Notch1 signaling promotes cardiogenic gene expression in mesenchymal stem cells[J]. Stem Cell Res Ther, 2013, 4(2):43. |
| [16] | Hilton M J, Tu X, Wu X, et al. Notch signaling maintains bone marrow mesenchymal progenitors by suppressing osteoblast differentiation[J]. Nat Med, 2008, 14(3): 306-314. |
| [17] | Jung S R, Song N J, Yang D K, et al. Silk proteins stimulate osteoblast differentiation by suppressing the Notch signaling pathway in mesenchymal stem cells[J]. Nutr Res, 2013,33(2): 162-170. |
| [18] | 谢佳瑛, 胥文春, 徐道晶, 等. Notch信号参与BMP9诱导的间充质干细胞成骨分化及其机制的初步探讨[J].中国生物工程杂志, 2012, 32(11):14-22. |
| [19] | Ann E J, Kim H Y, Choi Y H, et al. Inhibition of Notch1 signaling by Runx2 during osteoblast differentiation[J]. J Bone Miner Res, 2011, 26(2): 317-330. |
| [20] | Engin F, Yao Z, Yang T, et al. Dimorphic effects of Notch signaling in bone homeostasis[J]. Nat Med, 2008, 14(3): 299-305. |
| [21] | Zanotti S, Smerdel-Ramoya A, Stadmeyer L, et al. Notch inhibits osteoblast differentiation and causes osteopenia[J]. Endocrinology, 2008, 149(8): 3890-3899. |
| [22] | Long F. Targeting intercellular signals for bone regeneration from bone marrow mesenchymal progenitors[J]. Cell Cycle, 2008, 7(14): 2106-2111. |



